| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Ionisation
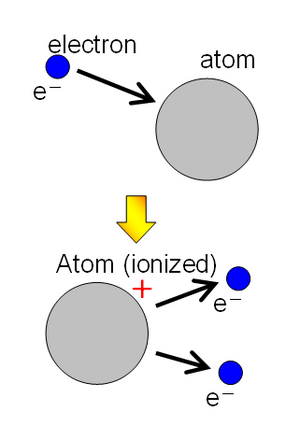
Ionisation heißt jeder Vorgang, bei dem aus einem Atom oder Molekül ein oder mehrere Elektronen entfernt werden, so dass das Atom oder Molekül als positiv geladenes Ion (Kation) zurückbleibt. Der umgekehrte Vorgang, bei dem ein Elektron von einem positiv geladenen Atom oder Molekül eingefangen wird, wird als Rekombination bezeichnet.
Eine weitere Form der Ionisation, die vor allem in der Chemie relevant ist, ist die Anlagerung von Elektronen an ein neutrales Atom oder Molekül, so dass ein negativ geladenes Ion (Anion) entsteht.
Ebenfalls kann Ionisation durch Anlagerung von Ionen (Protonen, Kationen, Anionen) erfolgen, z. B. in der Massenspektrometrie.
Wird der Kern eines Atoms aus der Elektronenhülle hinausgestoßen – z. B. durch ein schnelles Neutron – wird er dadurch ebenfalls zu einem Ion. Jedoch ist für diesen Vorgang die Bezeichnung Ionisation nicht üblich.
In der Literatur finden sich auch Formulierungen wie „Säuren, die bei Ionisierung schwach nucleophile Anionen liefern – wie z. B. HSO4− aus H2SO4 –, lassen sich in […].“[1] So kann in einem weiteren Sinn auch die Abspaltung eines Protons in einer Säure-Base-Reaktion unter dem Begriff Ionisation subsumiert werden.
Mechanismen
Zur Ionisation können verschiedene Prozesse führen:
- Ionisierende Strahlung (dazu zählen hier z. B. auch beschleunigte Elektronen in einer Thyratron-Röhre) kann durch Stoßionisation Elektronen aus ihrer Bindung „herausschlagen“. Die freigesetzten Elektronen können bei genügender Energie ihrerseits weiter ionisieren.
- Bei der Feldionisation werden Elektronen durch ein genügend starkes elektrisches Feld aus ihrer Bindung gelöst.
- Hoch angeregte Atome können durch Autoionisation selbstständig in einen ionisierten Zustand übergehen.
Symbolische Schreibweisen
Zur Beschreibung des Stoßionisationsprozesses werden häufig – analog der Schreibweise bei Kernreaktionen – Symbole wie (e,2e), (e,3e), (γ,2e) etc. benutzt. Hierbei steht das erste in der Klammer stehende Zeichen für das Projektil. Nach dem Komma stehen die produzierten freien Teilchen (zusätzlich zum ionisierten Atom und einschließlich des Projektils, sofern dieses nicht – wie im Falle des Photons – absorbiert wird). „2e“ bedeutet zum Beispiel, dass zwei freie Elektronen das Atom verlassen. Bei (e,2e) wird also durch Zusammenstoß eines Elektrons mit einem Atom ein einfach ionisiertes Atom erzeugt, bei (γ,2e) wird durch Wechselwirkung eines Photons mit einem Atom ein doppelt ionisiertes Atom produziert.
Ionisationsenergien

Für alle Ionisationsprozesse gilt, dass zur Trennung des Elektrons vom Atom oder Molekül Energie aufgebracht werden muss (Ionisationsenergie). Im vorangegangenen Abschnitt wurden mögliche Quellen für diese Energie genannt. Ionisationsenergien liegen typischerweise in der Größenordnung mehrerer Elektronenvolt (Beispiel Argon im Grundzustand: 15,7 eV). Ionisationsenergien sind abhängig vom zu ionisierenden Material und dessen aktuellem Anregungszustand. So wird es zunehmend schwieriger, bereits ionisierte Atome oder Moleküle weiter zu ionisieren. Die Ionisierungsenergie steigt mit jedem zu entfernenden Elektron aus der Elektronenschale exponentiell an.
Plasma
Ionisiertes Gas nennt man Plasma. Man unterscheidet zwischen Nieder-, Atmosphären- und Hochdruckplasmen. Nahezu die gesamte sichtbare Materie im Universum ist mehr oder weniger stark ionisiert.
Anwendungsbeispiele

Mittels Ionisatoren ionisierte, also elektrisch leitfähige Luft wird bei der Verarbeitung von Produkten verwendet, die sich elektrostatisch aufladen können, z. B. Folien- oder Papierrollen. Durch die Leitfähigkeit der Luft wird die Ladung abgebaut und so Gefahren des Funkenschlags und das Anziehen unerwünschter Staubpartikel beseitigt. Auch der Transport wird erleichtert.
„Niveau des Ionengehaltes in natürlichen Umgebungen und in Innenräumen:
- In unmittelbarer Nähe zu Wasserfällen 20.000–70.000 Ionen/cm³
- Im Gebirge oder in Meeresnähe 4.000–10.000 Ionen/cm³
- Am Stadtrand, auf Wiesen und in Feldern 1.000–3.000 Ionen/cm³
- Innerstädtische Parkanlagen 400–600 Ionen/cm³
- In der Stadt und Agglomeration 200–500 Ionen/cm³
- In belüfteten oder klimatisierten Räumen 10–100 Ionen/cm³“[2]
Diese Ionenkonzentrationen werden mit einem Ionometer gemessen. Hierbei kann die Polarität und die jeweilige Konzentration der Ionen bestimmt werden. Meist ist in der Natur das Verhältnis der natürlichen Polarität der Ionen ausgeglichen, mit einer leichten Tendenz zu mehr positiv geladenen Ionen. Die Ionenkonzentration hängt von der geologischen Beschaffenheit, der geographischen Lage und den Wetterbedingungen ab.
Ionisierte Luft wird zum Beispiel in der Lebensmittelindustrie bei der Pasteurisation von Bier und anderen Getränken eingesetzt. In der Getränkeabfüllung wird vor Füllbeginn die Flasche mit ionisierter Luft ausgeblasen, um Mikroorganismen abzutöten.
Ionisierende Strahlung wird bei industrieller Sterilisation (z. B. von medizinischen Einwegartikeln) benutzt.
Schadwirkungen
Durch die Ionenerzeugung entstehen in manchen Fällen Radikale, die zu chemischen Reaktionen und u. a. zur Bildung von Ozon, Stickoxiden und anderen Schadstoffen führen. Ozon kann die menschlichen Atmungsorgane beeinträchtigen und fördert Korrosion.
Siehe auch
- Ionisationsgerät, Ionisationsröhre, Ionenstrahlung, Ionisierende Strahlung, Ionenquelle, Ionisator
- Autoionisation
Einzelnachweise
- ↑ Sykes, P. (2001): „Wie funktionieren organische Reaktionen?: Reaktionsmechanismen für Einsteiger“. Wiley VCH Verlag GmbH., S. 89.
- ↑ Hochschule Luzern – ionisierte Luft im Innenraum (PDF-Datei), ausgegeben Januar 2013, S. 19, abgerufen 6. Juni 2013.
Weblinks
| Dieser Artikel basiert ursprünglich auf dem Artikel Ionisation aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |
