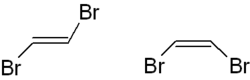| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Nomenklatur (Chemie)
Unter Nomenklatur versteht man in der Chemie die möglichst systematische und international möglichst einheitliche Namensgebung für chemische Stoffe. Dabei gilt heute als wichtig, dass ein Verbindungsname eindeutig ist und nur zu einer einzigen Strukturformel führt. Die Bezeichnung „Ethanol“ bezeichnet beispielsweise nur die Verbindung CH3-CH2-OH und keine andere. Umgekehrt haben chemische Verbindungen aber keinen eindeutigen Namen, z. B. kann man die Verbindung CH3-CH2-OH nach verschiedenen Nomenklatursystemen sowohl als „Ethanol“ als auch als „Ethylalkohol“ bezeichnen.
Geschichte
Bis ins 18. Jahrhundert war die Bezeichnung chemischer Stoffe sehr uneinheitlich. Einen wichtigen Schritt in Richtung Systematisierung stellte 1787 das Buch Méthode de nomenclature chimique von Louis Bernard Guyton de Morveau, Antoine Laurent de Lavoisier, Claude Louis Berthollet und Antoine François de Fourcroy dar. Jöns Jakob Berzelius führte um 1825 die chemische Zeichensprache mit Buchstaben für chemische Elemente ein. 1860 schlug ein Komitee unter Leitung von Friedrich August Kekulé ein internationales Bezeichnungssystem für organische Verbindungen vor. 1919 wurde die International Union of Pure and Applied Chemistry (IUPAC) gegründet. Seitdem betrachtet sie die Festlegung internationaler Standards für die chemische Nomenklatur als ihre Hauptaufgabe.
Die IUPAC-Nomenklatur
Um die Bezeichnungsweisen für chemische Verbindungen zu vereinheitlichen, gibt es die als international verbindlich vereinbarten Richtlinien der IUPAC (International Union of Pure and Applied Chemistry) und der IUBMB (International Union of Biochemistry and Molecular Biology) sowie deren als Ausgleichskommission eingesetzte Joint Commission on Biochemical Nomenclature. Diese regeln den englischen Sprachgebrauch. Die Bezeichnungen in anderen Sprachen werden von den nationalen Chemikerverbänden entsprechend übertragen, z. B. im deutschsprachigen Raum durch die Gesellschaft Deutscher Chemiker (GDCh), Schweiz und Österreich. Auch die IUPAC selbst verwendet in ihren Elementlisten viele englische Namen statt der den Elementkürzeln zugrunde liegenden (z. B. Potassium, Sodium, Tungsten, Mercury). Die Bedürfnisse verschiedener Sprachen und sogar des Englischen selbst werden von der IUPAC ausdrücklich anerkannt.[1] Besonders stringente Nomenklaturregelungen sind insbesondere für Index-Werke für chemische Stoffe wie Beilsteins Handbuch der Organischen Chemie und Chemical Abstracts bis vor kurzem notwendig gewesen, da deren System zur Auffindung von Einträgen bis zur Einführung elektronischer Recherche hauptsächlich danach erfolgte.
Da die systematische Bezeichnung von chemischen Verbindungen nach diesen Regeln oft sehr kompliziert ist, wird von den Chemikern im Alltagsgebrauch bis hin zu wissenschaftlichen Publikationen weiterhin eine große Anzahl von traditionellen Namen oder neu geschaffenen, anerkannten Kurznamen verwendet. Die IUPAC unterscheidet zwischen Trivialnamen, die keinen Bezug zur systematischen Nomenklatur haben (z. B. Wasser, Harnstoff oder Glaubersalz), semisystematischen Namen oder Semitrivialnamen, die zumindest einen Teil eines systematischen Namens verwenden (z. B. Kohlendioxid statt Kohlenstoffdioxid, Trityl für die Triphenylmethyl-Gruppe oder Glycerin für Propan-1,2,3-triol) und den bereits erwähnten systematischen Namen.[2] Auch für die Erfindung neuer Trivialnamen, z. B. von neu entdeckten Naturstoffen, gibt es IUPAC-konforme Regeln.
Ferner herrschen bei den Elementnamen die nationalen Gewohnheiten vor, und selbst die IUPAC-Elementwurzeln entsprechen nicht durchgängig dem für die Formelkürzel maßgebenden Namen (Beispiel Hg = Hydrargyrum, dt. Quecksilber, IUPAC-Wurzel „mercur“ wie engl. mercury und lat. Mercurius).
Zahlenpräfixe in chemischen Namen
Falls eine Art von Atomen oder Atomgruppen in einem Molekül mehrfach vorkommt, wird die Anzahl durch ein entsprechendes Zahlenpräfix (Vorsilbe) angegeben, das von den griechischen Zahlwörtern abgeleitet ist und dem Namen des entsprechenden Atoms bzw. der entsprechenden Atomgruppe vorangestellt wird.[3]
|
|
|
Beispiele:
- P4S7 Tetraphosphorheptasulfid
- SO3 Schwefeltrioxid
- CH2Cl2 Dichlormethan
Weglassen von Zahlenpräfixen
Bei Metallverbindungen nennt man nur die Wertigkeit bzw. Oxidationszahl, die das Metall in dieser Verbindung (Ionenbindung) besitzt. z. B.: CrO3 Chrom(VI)-oxid, gelesen Chrom-sechs-oxid, anstatt Chromtrioxid. Die Wertigkeit bzw. Oxidationszahl wird dabei mit römischen Zahlen angegeben. Falls der Name einer Verbindung dadurch eindeutig bleibt, kann man die Wertigkeit auch weglassen. So gibt es z. B. nur ein einziges Oxid des Aluminiums, nämlich Al2O3, weshalb man statt Aluminium(III)-oxid auch einfach Aluminiumoxid schreiben kann.
Sehr oft wird die Vorsilbe mono- weggelassen, z. B. PH3 = Phosphan (statt Monophosphan), obwohl es auch ein Diphosphan P2H4 gibt.
Alternative Zahlenpräfixe
Falls mehrere identische Gruppen vorhanden sind, bei denen die Verwendung der obigen Vorsilben missverständlich wäre, werden die folgenden aus dem griechischen hergeleiteten Präfixe verwendet:
| Anzahl | Vorsilbe (Präfix) |
|---|---|
| 2 | bis |
| 3 | tris |
| 4 | tetrakis |
| 5 | pentakis |
| 6 | hexakis |
| usw. |
Beispiele:
- Ca5F(PO4)3 Pentacalciumfluoridtrisphosphat - Durch Verwendung der Vorsilbe tris ist sofort klar, dass es sich nicht um die Triphosphatgruppe [P3O10]5− handelt, sondern um drei Phosphatgruppen [PO4]3−.
- 5,6-Bis(1,1-dimethylpropyl)undecan - die Verwendung der Vorsilbe bis zeigt sofort, dass es sich hier um zwei identische 1,1-Dimethylpropyl-Substituenten handelt.
Für die direkte Verknüpfung von identischen Einheiten verwendet man die folgenden Vorsilben, welche von den lateinischen Zahlwörtern abgeleitet sind:
| Anzahl | Vorsilbe (Präfix) |
|---|---|
| 2 | bi |
| 3 | ter |
| 4 | quater |
| 5 | quinque |
| 6 | sexi |
| 7 | septi |
| usw. |
Beispiel:
- C6H5-C6H5 heißt Biphenyl (und nicht Diphenyl oder Bisphenyl).
Anorganische Chemie
Elementnamen und -symbole
Die Namen der chemischen Elemente werden von den Entdeckern festgelegt und sind hier aufgeführt. Für unbekannte oder neue Elemente, die noch keinen Namen erhalten haben, gibt es systematische Elementnamen, die sich von der Kernladungszahl ableiten. Eine systematische Anordnung der Elemente nach ihrer Elektronenkonfiguration bietet das Periodensystem der Elemente.
Für einige Elemente existieren alte deutsche Bezeichnungen, die in mehreren Revisionen von der IUPAC an die im englischsprachigen angepasst wurden. Dies betraf vor allem Elementnamen, in denen die Buchstaben k und z gegen c ausgetauscht wurden. Beispiele sind Kalzium – Calcium, Silizium – Silicium oder Kobalt – Cobalt. Aber auch einige andere Schreibweisen wie Jod, das zu Iod verändert wurde oder Wismut zu Bismut wurden geändert. Während in der Chemie überwiegend die neuen Bezeichnungen verwendet werden, werden in anderen Bereichen und im allgemeinen Sprachbereich vielfach noch die alten Namen genutzt.
Für jedes Element existiert ein Kürzel aus ein bis drei Buchstaben (Elementsymbol). Für die Haupt- und Nebengruppenelemente sind diese Symbole untenstehend aufgelistet. Die Elementsymbole sind international gültig, sie werden also beispielsweise auch auf Japanisch durch lateinische Buchstaben wiedergegeben.
Will man ein bestimmtes Isotop eines Elements bezeichnen, so stellt man dessen Massenzahl hochgestellt vor das Elementsymbol, zum Beispiel 12C für das Kohlenstoff-12-Isotop, 235U für Uran 235, etc. Eine Ausnahme bilden die schweren Isotope des Wasserstoffs, 2H (Deuterium) und 3H (Tritium), welche mit D bzw. T ein eigenes Elementsymbol besitzen.
Um Verbindungen von verschiedenen Elementen untereinander zu benennen, werden die Elementnamen teilweise abgewandelt und mit Nachsilben versehen. Dazu verwendet man die Elementwurzeln in der folgenden Tabelle, welche aus den lateinischen bzw. griechischen Elementnamen abgeleitet sind. So wird beispielsweise der Sauerstoff in der Verbindung Aluminiumoxid (Al2O3) durch seine Elementwurzel (ox) und die Endung -id angegeben.
Hauptgruppenelemente
Elementsymbol Name Wurzel 1. Hauptgruppe, Alkalimetalle H Wasserstoff hydr Li Lithium lith Na Natrium natr K Kalium kal Rb Rubidium rubid Cs Caesium caes Fr Francium franc 2. Hauptgruppe, Erdalkalimetalle Be Beryllium beryl Mg Magnesium magnes Ca Calcium calc Sr Strontium stront Ba Barium bar Ra Radium rad 3. Hauptgruppe, Borgruppe oder Erdmetalle B Bor bor Al Aluminium alumin Ga Gallium gall In Indium ind Tl Thallium thall 4. Hauptgruppe, Kohlenstoffgruppe C Kohlenstoff carb (bei Carbonaten und Thiocarbonaten: carbon) Si Silicium silic Ge Germanium german Sn Zinn stann Pb Blei plumb 5. Hauptgruppe, Stickstoffgruppe N Stickstoff nitr P Phosphor phosph As Arsen arsen Sb Antimon antimon Bi Bismut bismut 6. Hauptgruppe, Chalkogene O Sauerstoff ox S Schwefel sulf, auch: thio Se Selen selen Te Tellur tellur Po Polonium polon 7. Hauptgruppe, Halogene F Fluor fluor Cl Chlor chlor Br Brom brom I Iod iod At Astat astat 8. Hauptgruppe, Edelgase He Helium Ne Neon Ar Argon Kr Krypton Xe Xenon Rn Radon
Übergangselemente
| Elementsymbol | Name | Wurzel |
|---|---|---|
| 3. Nebengruppe | ||
| Sc | Scandium | scand |
| Y | Yttrium | |
| La | Lanthan | |
| 4. Nebengruppe | ||
| Ti | Titan | titan |
| Zr | Zirconium | zircon |
| Hf | Hafnium | hafn |
| 5. Nebengruppe | ||
| V | Vanadium | vanad |
| Nb | Niob | niob |
| Ta | Tantal | tantal |
| 6. Nebengruppe | ||
| Cr | Chrom | chrom |
| Mo | Molybdän | molybd |
| W | Wolfram | wolfram, (auch: tungs) |
| 7. Nebengruppe | ||
| Mn | Mangan | mangan |
| Tc | Technetium | techn |
| Re | Rhenium | rhen |
| 8. Nebengruppe, Eisen- und Platinmetalle | ||
| Fe | Eisen | ferr |
| Co | Cobalt | cobalt |
| Ni | Nickel | niccol |
| Ru | Ruthenium | ruthen |
| Rh | Rhodium | rhod |
| Pd | Palladium | pallad |
| Os | Osmium | osm |
| Ir | Iridium | irid |
| Pt | Platin | platin |
| 1. Nebengruppe, Münzmetalle | ||
| Cu | Kupfer | cupr |
| Ag | Silber | argent |
| Au | Gold | aur |
| 2. Nebengruppe, Zinkgruppe | ||
| Zn | Zink | zinc |
| Cd | Cadmium | cadm |
| Hg | Quecksilber | mercur |
Formeln von anorganischen Verbindungen
Beim Schreiben von Formeln von chemischen Verbindungen folgt man im Wesentlichen der Elektronegativitätsskala der chemischen Elemente. Man beginnt immer mit dem elektropositiveren Verbindungspartner, deshalb schreibt man etwa AgCl, Al2O3, PCl5 und nicht umgekehrt.
Eine Ausnahme von dieser Regel sind die Wasserstoffverbindungen. Wasserstoffatome schreibt man in den Formeln an letzter Stelle (NH3, SiH4, etc.). Handelt es sich jedoch um aciden Wasserstoff (d. h. die Verbindung reagiert in wässriger Lösung sauer), so schreibt man den Wasserstoff am Anfang der Formel (HF, HCl, HBr, HI, H2O, H2O2, H2S, H2Se, H2Te). Bei der Benennung dieser Verbindungen wird beispielsweise neben dem Namen „Hydrogenfluorid“ für HF oder „Hydrogenchlorid“ für HCl auch der insbesondere im Labor wesentlich gebräuchlichere Name Fluorwasserstoff bzw. Chlorwasserstoff verwendet. Letztere sind aufgrund der eindeutigeren Bezeichnung insgesamt zu bevorzugen, da es sich bei diesen Verbindungen nicht um Salze mit den entsprechenden Anionen handelt, sondern aufgrund der hohen Elektronegativitätszahlen nur um stark partiell geladene Dipolverbindungen, in denen eine stark polare kovalente Bindung (Atombindung) vorliegt. Außerdem ist aufgrund der Eindeutigkeit bei der Benennung zu beachten, dass beispielsweise unter „Hydrogenfluorid“ Salze des Typs MHF bzw. MF×HF (mit M = einwertiges Metall) verstanden werden, somit ist Fluorwasserstoff bevorzugt zu verwenden. Auch bei anorganischen Oxosäuren schreibt man den Wasserstoff am Anfang der Formel, obwohl er eigentlich am Sauerstoff gebunden ist, also für Schwefelsäure zum Beispiel H2SO4 statt SO2(OH)2.
Kationen (auch nur formale) behalten grundsätzlich den Elementnamen. Anionen erhalten ihren Namen systematisch nach der Säure, von der sie abgeleitet werden, unabhängig davon, ob es sich tatsächlich um eine Ionenbindung oder kovalente Bindung handelt. Die Nomenklatur bei koordinativen Verbindungen, also Komplexen, funktioniert ein wenig komplizierter und wird dort genauer beschrieben.
Anionen der Wasserstoffsäuren (-id)
Die einfachsten Anionen sind die der Wasserstoffsäuren. Bei ihnen bleibt nach Abgabe des Protons das Elementanion zurück.
Diese Anionen bilden ihre Endung mit id an den Elementnamen angehängt. Die wichtigsten sind:
- 7. Hauptgruppe (Halogenide)
Fluorid (F−), Chlorid (Cl−), Bromid (Br−), Iodid (I−)
Beispiel:
- SF6 Schwefelhexafluorid
- 6. Hauptgruppe
Oxid (O2−), Sulfid (S2−), Selenid (Se2−)
Beispiel:
- Na2S Natriumsulfid
- 5. Hauptgruppe
Nitrid (N3−), Phosphid (P3−)
Beispiel:
- Na3N Natriumnitrid
- 4. Hauptgruppe
kommen selten vor
Beispiel:
- SiC Siliciumcarbid
Sauerstoff- oder Oxosäuren und ihre Anionen
Alle Endungen außer „id“ sind auf Säuren zurückzuführen, die neben dem namensgebenden Element Sauerstoff enthalten. Da es eine große Menge dieser Verbindungen gibt, wird zunächst die Systematik erklärt und die einzelnen Säuren in einer Tabelle am Ende des Absatzes angegeben.
Elementsäuren (-at)
hier gilt allgemein:
7. Hauptgruppe:
Halogensäure HXO3 z. B. Chlorsäure HClO3 mit dem Anion Chlorat (ClO3−)
6. Hauptgruppe:
Elementsäure H2XO4 z. B. Schwefelsäure H2SO4 mit dem Anion Sulfat (SO42−)
5. Hauptgruppe:
Elementsäure H3XO4 z. B. Phosphorsäure H3PO4 mit dem Anion Phosphat (PO43−); Ausnahme: Salpetersäure
4. Hauptgruppe:
Elementsäure H2XO3 z. B. Kohlensäure H2CO3 mit dem Anion Carbonat (CO32−)
3. Hauptgruppe:
Elementsäure H3XO3 z. B. Borsäure H3BO3 mit dem Anion Borat (BO33−)
Per-säuren (per…-at)
Diese Säuren haben zusätzlich ein Sauerstoffatom. Es gibt sie nicht von allen Sauerstoffsäuren, aber falls sie gebildet werden, erhöht sich die Oxidationsstufe des Elements gegenüber der Sauerstoffsäure. Hauptsächlich werden diese Säuren von den Halogenen gebildet:
7. Hauptgruppe:
Perhalogensäure HXO4 z. B. Perchlorsäure HClO4 mit dem Anion Perchlorat (ClO4−)
„Elementige“ Säuren (-it)
Diese Säuren haben ein Sauerstoffatom weniger als die Elementsäuren. z. B. Salpetrige Säure HNO2 mit dem Anion Nitrit (NO2−), Chlorige Säure HClO2 mit dem Anion Chlorit (ClO2−), Schweflige Säure H2SO3 mit den Anionen Hydrogensulfit (HSO3−) und Sulfit (SO32−).
„Hypoelementige“ Säuren (hypo…-it)
Diese Säuren haben zwei Sauerstoffatome weniger als die Elementsäuren, z. B. Hypochlorige Säure HClO mit dem Anion Hypochlorit (ClO−).
Mehrere Oxidationsstufen des elektropositiven Partners
Existieren mehrere Oxidationsstufen für ein Metallatom, so wird die in einer Verbindung vorliegende Oxidationsstufe durch eine nachgestellte, in Klammern gesetzte, römische Ziffer angegeben. Beispielsweise Eisen(II)-oxid = FeO oder Eisen(III)-oxid = Fe2O3
Komplexe Anionen
Es gibt auch Richtlinien für die Benennung von Komplexen, die im Artikel Komplexchemie erläutert werden.
Radikale
Zur Benennung des Radikals wird dem Stammnamen die Endung -yl angehängt. Dies gilt sowohl in der organischen wie auch in der anorganischen Chemie.
Beispiele: HO•: Hydroxyl (Stamm: Hydrox-) und •CH3: Methyl (Stamm: Meth-)
Einige Radikale haben, besonders bei den Sauerstoffverbindungen, spezielle Namen.
Salzhydrate
Einteilung nach der Struktur
Liste von Oxosäuren und -anionen
Organische Chemie
Für die Benennung von organischen Verbindungen nach dem IUPAC-System geht man üblicherweise von einem Stammsystem aus, das unter Umständen weitere Substituenten (Reste) trägt. Ein Substituent ist dabei ein Atom oder eine Atomkombination, welche ein Wasserstoffatom des Stammsystems ersetzt (substituiert). Für die Benennung der Verbindung wird der Name des Stammsystems unverändert übernommen und die Namen der substituierenden Gruppen werden dem Stammsystem in abgewandelter Form angefügt (substitutive Nomenklatur).
Als Ergänzung zum Stammsystem wird bei entsprechenden Verbindungen ein Deskriptor genannter Präfix vor dem systematischen Substanznamen ergänzt (z. B. cis-, trans-, (E)-, (Z)-, o-, m-, p-, n-, iso-, neo-, cyclo-, sec-, tert-, D-, L-, (±)-), der die Konfiguration oder die Stereochemie des Moleküls beschreibt. Häufig werden Deskriptoren in Kombination mit Lokanten (z. B. O-, N-, S-, α-, β-, [3.3]) zur genauen Beschreibung bestimmter Positionen von Atomen oder Bindungen verwendet, um eine chemische Struktur eindeutig zu benennen.
Stammsysteme
Lineare Ketten
Die einfachsten Stammsysteme sind lineare Ketten aus Kohlenstoffatomen, bei denen alle übrigen Bindungen mit Wasserstoffatomen gesättigt sind. Solche gesättigte Kohlenwasserstoffe nennt man Alkane, sie erhalten die Endung -an. Für die vier kleinsten Alkane werden die Namen Methan, Ethan, Propan und Butan beibehalten, für die übrigen Alkane ergibt sich der genaue Name der Verbindung nach der folgenden Tabelle aus der Anzahl der Kohlenstoffatome. Man kombiniert das Zahlwort der ersten Dekade mit den Zahlwörtern für die folgenden Dekaden. Am Ende folgt ein n, sodass man die Alkan-typische Endung -an erhält.
| 1 | Hen | 10 | Deca | 100 | Hecta | 1000 | Kilia | |||
| 2 | Do | 20 | Cosa | 200 | Dicta | 2000 | Dilia | |||
| 3 | Tri | 30 | Triaconta | 300 | Tricta | 3000 | Trilia | |||
| 4 | Tetra | 40 | Tetraconta | 400 | Tetracta | 4000 | Tetralia | |||
| 5 | Penta | 50 | Pentaconta | 500 | Pentacta | 5000 | Pentalia | |||
| 6 | Hexa | 60 | Hexaconta | 600 | Hexacta | 6000 | Hexalia | |||
| 7 | Hepta | 70 | Heptaconta | 700 | Heptacta | 7000 | Heptalia | |||
| 8 | Octa | 80 | Octaconta | 800 | Octacta | 8000 | Octalia | |||
| 9 | Nona | 90 | Nonaconta | 900 | Nonacta | 9000 | Nonalia |
Beispiele:
- C32H66 = Dotriacontan (Do + Triaconta + n)
- C99H200 = Nonanonacontan (Nona + Nonaconta + n)
- C403H808 = Tritetractan (Tri + Tetracta + n)
- C4728H9458 = Octacosaheptactatetralian (Octa + Cosa + Heptacta + Tetralia + n)
- C9999H20000 = Nonanonacontanonactanonalian (Nona + Nonaconta + Nonacta + nonalia + n)
Ausnahmen von der Benennung nach der obigen Tabelle gibt es bei:
| Anzahl der C-Atome | Verbindung | Name |
|---|---|---|
| 1 | CH4 | Methan |
| 2 | C2H6 | Ethan |
| 3 | C3H8 | Propan |
| 4 | C4H10 | Butan |
| 11 | C11H24 | Undecan |
| 20 | C20H42 | Icosan |
| 21 | C21H44 | Henicosan |
Falls eine Doppelbindung in der Verbindung vorhanden ist, spricht man von Alkenen und verwendet statt der Endung -an die Endung -en. Die Position der Doppelbindung wird durch eine Nummer angegeben siehe unten bei Nummerierung, z. B.
- CH2=CH-CH2-CH3 heißt But-1-en (früher 1-Buten),
- CH3-CH=CH-CH3 heißt But-2-en.
Bei Ketten, die eine Dreifachbindung enthalten (= Alkinen), wird die Endung -in verwendet, z. B.
- CH≡C-CH2-CH3 heißt But-1-in (früher 1-Butin),
- CH2=CH-CH2-C≡C-CH2-CH3 heißt Hept-1-en-4-in.
Falls mehrere Doppel- oder Dreifachbindungen vorkommen, verwendet man die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta, …
- CH2=CH-CH=CH2 heißt also Buta-1,3-dien,
- CH≡C-C≡C-C≡C-CH3 heißt Hepta-1,3,5-triin.
Bestimmung der Hauptkette bei verzweigten acyclischen Kohlenwasserstoffen
Die Hauptkette (Stammsystem) ist jene Kette, welche
- die größte Zahl an Mehrfachbindungen enthält
- bei Mehrdeutigkeit von (1): die größere Zahl von C-Atomen enthält
- bei Mehrdeutigkeit von (2): die größere Zahl von Doppelbindungen enthält
- bei Mehrdeutigkeit von (3): den niedrigsten Lokantensatz für die Mehrfachbindungen hat.
- bei Mehrdeutigkeit von (4): den niedrigsten Lokantensatz für die Doppelbindungen hat.
- bei Mehrdeutigkeit von (5): die größere Zahl von Substituenten hat.
- bei Mehrdeutigkeit von (6): den niedrigsten Lokantensatz für die Substituenten hat.
- bei Mehrdeutigkeit von (7): den alphabetisch geordnet ersten Substituenten hat.
- bei Mehrdeutigkeit von (8): den niedrigsten Lokanten für den alphabetisch ersten Substituenten hat.
Hinweis zum Lokantensatz:
Ein Lokantensatz ist die Aufzählung der Lokanten wie z. B. 2,4 im 2,4-Dimethyl-heptan. Der „niedrigste Lokantensatz“ bedeutet nun nicht die kleinste Summe der Lokanten, vielmehr vergleicht man die Lokanten der Reihe nach. Der kleinste Lokantensatz ist der, der an der ersten unterscheidbaren Stelle den kleineren Lokanten aufweist.
Cyclische Systeme ohne Heteroatome
Bei cyclischen Systemen ist im Allgemeinen ein Cyclus das Stammsystem.
Monocyclische Systeme
Falls es sich um eine monocyclische Verbindung handelt, erfolgt die Benennung wie bei linearen Ketten, und zusätzlich wird die Vorsilbe Cyclo- vorangestellt, also z. B. Cyclohexan. Für Benzol wird der Trivialname beibehalten.
Monocyclische Verbindungen mit mehr als sechs C-Atomen, die die maximale Anzahl nichtkumulierter Doppelbindungen aufweisen, können als (n)-Annulene bezeichnet werden (n = Anzahl der C-Atome).
Cyclische Systeme werden bevorzugt nach dem Hantzsch-Widman-System bezeichnet.
Kondensierte polycyclische Systeme
Bei kondensierten polycyclischen Kohlenwasserstoffen (d. h. die einzelnen Ringe sind jeweils über genau eine gemeinsame Bindung verknüpft) ist jene Komponente das Basissystem, welche
- die meisten Ringe aufweist
- den größten Ring aufweist
Dabei werden folgende Polycyclen als eigene Systeme aufgefasst (in ansteigender Priorität, in Klammern die Anzahl der Ringe):
Pentalen (2), Inden (2), Naphthalin (2), Azulen (2), Heptalen (2), Biphenylen (3), as-Indacen (3), s-Indacen (3), Acenaphthylen (3), Fluoren (3), Phenalen (3), Phenanthren (3), Anthracen (3), Fluoranthen (4), Acephenanthrylen (4), Aceanthrylen (4), Triphenylen (4), Pyren (4), Chrysen (4), Naphthacen (4), Pleiaden (Chemie) (4), Picen (5), Perylen (5), Pentaphen (5), Pentacen (5), Tetraphenylen (5), Hexaphen (6), Hexacen (6), Rubicen (7), Coronen (7), Trinaphthylen (7), Heptaphen (7), Heptacen (7), Pyranthren (8), Ovalen (10).
Alle übrigen Ringe werden als Vorsilben vorangestellt, wobei die Endsilbe -en in -eno umgewandelt wird (z. B. Benzocycloocten). Die Art der Verknüpfung wird durch Zahlen und Buchstaben angegeben, was aber hier nicht näher erläutert werden soll.
Zur Benennung von gesättigten oder teilweise gesättigten Derivaten der oben angeführten Polycyclen gibt es die Möglichkeit, beim Wegfallen einer Doppelbindung die beiden zusätzlichen Wasserstoffatome durch die Positionsnummern und die Vorsilbe dihydro- anzuzeigen. Analog gibt es tetrahydro-, hexahydro- usw. Vollständig gesättigte Systeme erhalten die Vorsilbe perhydro-. Einzelne Wasserstoffatome werden durch das sogenannte indizierte H angegeben, welches in kursiver Schrift vorangestellt wird (z. B. 4H-Pyrazol).
Cyclophane können nach den gleichen Regeln benannt werden, obwohl es für diese auch eine eigene Nomenklatur gibt.
Verbrückte polycyclische Systeme
Bei verbrückten polycyclischen Kohlenwasserstoffen (d. h. die einzelnen Ringe sind jeweils über mehr als eine gemeinsame Bindung verknüpft) wird das von-Baeyer-System verwendet.
Spiroverbindungen
In Spiroverbindungen sind die Ringe über ein gemeinsames Atom verbunden.
Nomenklatur: Substituenten-spiro[Anzahl Atome im kleineren Ring . Anzahl Atome im grössern Ring]Stammname (Ringgrösse wird ohne Spiro-Atom angegeben). Beispiel: 1-Brom-3-chlor-spiro[4.5]decan-7-ol.
Kompliziertere Systeme
Die Entscheidung, was nun als Stammsystem betrachtet wird, ist bei komplizierteren Verbindungen nicht mehr ganz einfach.
Heterocyclen
Sofern keine Trivialnamen vorliegen, benennt man monocyclische Heterocyclen mit bis zu 10 Ringgliedern meist nach dem Hantzsch-Widman-System.
Bei kondensierten Polycyclen haben Heterocyclen Vorrang gegenüber Carbocyclen (= Ringen, die nur aus Kohlenstoffatomen bestehen). Auch für Heterocyclen gibt es dabei Systeme mit Trivialnamen, welche als eigene Stammsysteme aufgefasst werden (ohne Reihung und unvollständig):
Ansonsten folgt die Benennung von Heterocyclen weitgehend den oben angeführten Regeln für cyclische Systeme ohne Heteroatome. Die Art und Position der Heteroatome wird dann mit Hilfe der Austauschnomenklatur oder „a“-Nomenklatur angegeben.
Substituenten (Reste)
Ein Substituent kann z. B. eine funktionelle Gruppe sein, oder wiederum ein (kleineres) Stammsystem, etwa eine Seitenkette. Die Bezeichnungen für Substituenten werden dem Namen des Stammsystems als Vorsilben (Präfixe) oder Endungen (Suffixe) angefügt. Die genaue Position des Substituenten wird durch Ziffern präzisiert (siehe unten bei Nummerierung).
Falls es mehrere Vorsilben (Präfixe) gibt, werden diese in alphabetischer Reihenfolge aufgelistet.
Stammsysteme als Substituenten
Falls es sich beim Rest wiederum um ein Stammsystem handelt, zum Beispiel eine Seitenkette oder einen Ring, so wird an dessen Namen die Silbe -yl angehängt und das Ergebnis als Vorsilbe (Präfix) vorangestellt. Die Benennung von Seitenketten erfolgt nach den gleichen Regeln wie für die Grundkette, bis auf folgende Ausnahmen:
- bei Alkanen wird die Endung -an weggelassen
- die Nummerierung der Seitenkette startet immer bei der Verknüpfung mit der Hauptkette
Beispiele:
- Methyl: -CH3
- Ethyl: -CH2-CH3
- Ethinyl: -C≡CH
- Prop-2-enyl (Allyl): -CH2-CH=CH2
- Cyclohexyl: -C6H11
Wenn man beispielsweise an die Verbindung Propan (CH3-CH2-CH3) in der Mitte noch einen Methanbaustein anhängt, heißt die entstehende Verbindung CH3-CH(CH3)-CH3 dann 2-Methylpropan. Die Verbindung CH3-CH2-CH(CH3)-CH2-CH(CH2CH3)-CH2-CH3 heißt 3-Ethyl-5-methylheptan.
Seitenketten mit Doppelverbindung zur Grundkette erhalten die Endung -ylen (Methylen: =CH2), bei einer Dreifachverbindung -ylidin (Methylidin: ≡CH).
Funktionelle Gruppen
Die ranghöchste funktionelle Gruppe wird als Endung (Suffix) hinten angestellt, übrige funktionelle Gruppen als Vorsilben (Präfixe) vorangestellt:
- CH3-CH(OH)-CH3 heißt Propan-2-ol
- CH3-CH2-CH2-C(OOH) heißt Butansäure
- CH3-CH(OH)-CH2-CH(NH2)-CH2-CH3 hat zwei funktionelle Gruppen. Der Alkohol hat höhere Priorität, deshalb heißt die Verbindung 4-Amino-2-hexanol.
Für die Bezeichnungen einzelner funktioneller Gruppen und ihre Rangfolge siehe das Stichwort Funktionelle Gruppe.
Trivialnamen
Für manche Substituenten gibt es Trivialnamen, welche z. T. auch verbindlich sind, wie z. B.:
- Phenyl: -C6H5
- Benzyl: -CH2-C6H5
- Isopropyl: -CH-(CH3)2
- Vinyl: -CH=CH2
- u. v. m.
Nummerierung
Die Nummerierung des Stammsystems erfolgt so, dass die erhaltenen Nummern möglichst klein sind. CH3-CH2-CH2-CH(CH3)-CH3 heißt also 2-Methylpentan und nicht 4-Methylpentan.
Falls es nur eine mögliche Kombination gibt, können die Nummern weggelassen werden (z. B. 2-Methylpropan = Methylpropan, da es kein anderes Methylpropan gibt).
Falls Seitenketten nummeriert werden müssen, ist die Verbindungsstelle zur Hauptkette immer die Position 1.
Für natürlich vorkommende Derivate des Glycerins gilt für die Nummerierung der C-Atome nach IUPAC die sn-Nomenklatur.[4]
Bei kondensierten polycyclischen Systemen existieren ggf. verbindliche Nummerierungsschemata, die jeweils nachgeschlagen werden müssen (siehe z. B. Steran-Grundgerüst).
Die Positionsnummern werden Lokanten genannt.
Mehrfach vorkommende Substituenten
Für mehrfach vorkommende gleiche Gruppen werden die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta, … (siehe oben) verwendet:
- ein Benzolring mit drei Methylgruppen an den Positionen 1, 3 und 5 heißt 1,3,5-Trimethylbenzol,
- ein Methan mit vier Chloratomen heißt Tetrachlormethan.
- ein Ether mit zwei Ethylgruppen heißt Diethylether usw.
Falls die Verwendung von di, tri, tetra usw. missverständlich wäre, etwa bei identischen weitersubstituierten Seitenketten, muss man wie oben beschrieben die entsprechenden alternativen Vorsilben bis, tris, tetrakis usw. verwenden. Für direkt verknüpfte identische Einheiten sind die Vorsilben bi, ter, quater usw. in Verwendung.
Beispiel
Nach IUPAC-Nomenklatur muss zum Beispiel die Verbindung
NH2-CH2-CH2-OH
den Namen 2-Aminoethanol erhalten.
Auf folgende Weise gelangt man zu diesem Namen:
- Da die Kohlenstoffatome nur Einfachbindungen aufweisen, erhält die Wurzel als erste Endung „an“.
- Die Grundkette enthält zwei Kohlenstoffatome; damit ergibt sich die Wurzel „eth“. (→ „ethan“)
- Als funktionelle Gruppen sind enthalten eine Alkohol-(OH) und eine Aminogruppe (NH2). Die Alkoholgruppe hat die höhere Priorität und erhält Vorrang vor der Aminogruppe. Also wird „ol“ hinten angehängt. (→ „ethanol“)
- Die Aminogruppe befindet sich nicht am selben Kohlenstoffatom wie die Alkoholgruppe (Atom Nr. 1), sondern an dem daneben (Nr. 2). Deshalb wird der Ort angegeben durch „2-Amino“.
- Die Kombination von Vorsilbe, Wurzel und Endungen ergibt den Namen „2-Aminoethanol“.
Stereochemie
Chirale Verbindungen
Zur Unterscheidung von chiralen Verbindungen gibt es die kursiv geschriebenen Vorsilben (R)- und (S)-. Ihre Verwendung wird durch die Cahn-Ingold-Prelog-Regel (CIP-Regel) und ihre Nebenregeln festgelegt. Wenn eine chirale Verbindung als 1:1.Gemisch der Enantiomeren vorliegt – also ein Racemat ist – benutzt man die Vorsilbe (RS)-. Wenn ein Stereozentrum in einer chiralen Verbindung einheitlich vorliegt, aber aus irgendwelchen Gründen die Konfiguration (R)- oder (S)- unklar ist, benutzt man als Vorsilbe (Ξ)- (griechischer Buchstabe Xi).
Bei biochemischen Substanzen wie Kohlenhydraten und Aminosäuren wird auch noch häufig die Fischer-Nomenklatur verwendet, welche die Vorsilben D- und L- verwendet (wobei D und L als Kapitälchen geschrieben werden).
Zur Unterscheidung des Drehsinns bei optisch aktiven Verbindungen verwendet man die Vorsilben (+)- und (−)-, wobei kein Zusammenhang zwischen der optischen Aktivität (Drehsinn) und der „Richtung“ Chiralität besteht.
Es sei darauf hingewiesen, dass sich die unterschiedlichen Bezeichnungsweisen (R, S bzw. D, L und +, −) nach den verschiedenen Nomenklaturarten nicht von den jeweils anderen Bezeichnungen ableiten lassen. Zur systematischen Bezeichnung von Verbindungen mit mehreren Chiralitätszentren eignen sich nur die CIP-Regeln, wobei die Fischer-Nomenklatur beispielsweise für Zucker wesentlich kompakter ist.
cis-trans-Isomere
Bei der cis-trans-Isomerie unterscheidet man bei der Nomenklatur zwischen Verbindungen, die nur zwei verschiedene Substituenten haben, und Verbindungen mit mehr als zwei. Erstere werden mit den kursiv geschriebenen Vorsilben cis- oder trans- gekennzeichnet. cis-Doppelbindungen werden meist – aber nicht durchgängig – nach IUPAC mit einem vorangestellten, kursiven (Z) („Zusammen“) und trans-Doppelbindungen mit einem (E) („Entgegengesetzt“) gekennzeichnet. Genau genommen stehen bei einem (Z)-Isomer jene zwei Substituenten an benachbarten Atomen einer Doppelbindung auf derselben Seite des Moleküls, die die höchste Priorität im Cahn-Ingold-Prelog-System haben, beim (E)-Isomer stehen die Substituenten mit der höchsten CIP-Priorität also auf entgegengesetzten Seiten des Moleküls.
Links ist das trans-1,2-Dibromethen, rechts die cis-Version dargestellt. Auch kann man hier die (E,Z)-Nomenklatur anwenden, trans-1,2-Dibromethen wird als (E)-1,2-Dibromethen, "cis" als (Z)-1,2-Dibromethen bezeichnet.
Auch hier am Ring sind die beiden Bromatome in trans- (links) und cis-Stellung („Zusammen“ auf einer Seite) dargestellt.
Das ist ein (Z)-3-Methylpent-2-en, da die ranghöheren Substituenten (siehe Stereochemie) auf einer Seite liegen.
Anomere
Bei Kohlenhydraten unterscheidet man Anomere durch die kursiven Vorsilben α- bzw. β-.
Biochemie
Für die Nomenklatur von Enzymen gibt es gemeinsame Richtlinien der IUPAC und der IUBMB (International Union of Biochemistry and Molecular Biology). Nach dieser Nomenklatur enden Enzymnamen mit -ase und enthalten eine Information über die Funktion des Enzyms. Details unter dem Stichwort Enzym und auf der Website der IUBMB.
Außerdem wurde ein Codesystem (siehe EC-Nummern) entwickelt, in dem die Enzyme unter einem Zahlencode aus vier Ziffern zu finden sind.
Für Nukleinsäuren gilt die Nukleinsäure-Nomenklatur.
Chemische Nomenklatur außerhalb der IUPAC-Vorschriften
- Für Kunststoff-Bezeichnungen gibt es durch eine DIN-Norm festgelegte Kurzzeichen.
- Für Lebensmittelzusatzstoffe gibt es das System der E-Nummern.
Literatur
- IUPAC, Gerlinde Kruse (Hrsg.): Nomenklatur der Organischen Chemie – Eine Einführung. 1. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-29327-2.
- Karl-Heinz Hellwich: Chemische Nomenklatur. GOVI-Verlag, ISBN 3-7741-0815-3.
- D. Hellwinkel: Die systematische Nomenklatur der organischen Chemie. Eine Gebrauchsanweisung. 5., korr., erw. u. erg. Auflage. Springer, Berlin 2005, ISBN 3-540-26411-6.
- Wolfgang Holland: Die Nomenklatur in der organischen Chemie. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1973, DNB 730400123.
- Philipp Fresenius, Klaus Görlitzer: Organisch-chemische Nomenklatur: Grundlagen·Regeln·Beispiele. 4. durchgesehene und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1588-5.
- Ursula Bünzli-Trepp: Nomenklatur der Organischen Chemie, Metallorganischen Chemie und Koordinationschemie. Logos Verlag, Berlin 2001, ISBN 3-89722-682-0.
- Wolfgang Liebscher: Handbuch zur Anwendung der Nomenklatur organisch-chemischer Verbindungen. Akademie-Verlag, Berlin 1979, DNB 790313952.
- Wolfgang Liebscher, Ekkehard Fluck (Hrsg.): Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 2013, ISBN 9783642583681, doi:10.1007/978-3-642-58368-1, 388 Seiten.
Weblinks
- Nomenklatur (PDF des Instituts für Analytische Chemie der Uni Regensburg; 55 kB)
englisch
- IUPAC Website (englisch)
- IUBMB Website (englisch)
- IUPAC Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. (englisch)
- IUPAC-Regeln zur Nomenklatur in der organischen Chemie (englisch)
- IUPAC-Nomenklatur in der Stereochemie (englisch)
- Vergleich von mit Nomenklatursoftware generierten mit von Autoren veröffentlichten chemischen Namen. Gernot A. Eller: Improving the Quality of Published Chemical Names with Nomenclature Software. In: Molecules. 2006, 11, S. 915-928 (Onlineartikel auf Englisch) (PDF; 103 kB)
Einzelnachweise
- ↑ IUPAC Nomenclature of Organic Chemistry, Introduction, R-0.1 Conventions.
- ↑ IUPAC Nomenclature of Organic Chemistry, R-0.2.3 Names..
- ↑ Table 11 Basic numerical terms (multiplying affixes). IUPAC Nomenclature of Organic Chemistry, Recommendations 1993.
- ↑ IUPAC: Nomenclature of Lipids: Recommendations Lip-1 and Lip-2..
| Dieser Artikel basiert ursprünglich auf dem Artikel Nomenklatur (Chemie) aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |