| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Butane
| Eigenschaften der Butane | ||
| Name | n-Butan[1] | Isobutan[2] |
| Strukturformel | 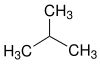
| |
| CAS-Nummer | 106-97-8 | 75-28-5 |
| PubChem | 7843 | 6360 |
| Summenformel | C4H10 | |
| Molare Masse | 58,12 g·mol−1 | |
| Schmelzpunkt | −138,29 °C | −159,42 °C |
| Siedepunkt | −0,50 °C | −11,7 °C |
| Dampfdruck (20 °C) | 208 kPa | 301,9 kPa |
| Dichte (Gas, 0 °C, 1013 mbar) | 2,71 kg·m−3 | 2,70 kg·m−3 |
| Dichte (Flüssigkeit am Siedepunkt) | 0,59 kg·l−1 | 0,60 kg·l−1 |
| Heizwert | 46 MJ·kg−1 (12,72 kWh·kg−1) 119 MJ·m−3 (34,32 kWh·m−3) | |
| Löslichkeit in Wasser bei 20 °C | 61 mg·l−1 | 49 mg·l−1 |
| Untere Explosionsgrenze (UEG) |
1,4 Vol.‑% | 1,5 Vol.‑% |
| 33 g·m−3 | 37 g·m−3 | |
| Obere Explosionsgrenze (OEG) |
9,4 Vol.‑% | |
| 231 g·m−3 | ||
Die Butane sind eine Stoffgruppe innerhalb der Alkane, die die Summenformel C4H10 aufweisen. Sie besteht aus den beiden Vertretern n-Butan und iso-Butan, die zueinander isomer sind. Beide Butane sind farblose, brennbare, leicht zu verflüssigende Gase („Flüssiggase“), die sich kaum in Wasser, aber gut in Ethanol und Ether lösen.[3]
Vorkommen und Darstellung
Butane kommen natürlich im Erdgas vor, werden aber auch durch Cracken aus Erdöl gewonnen. Eine Trennung der beiden Isomere kann durch Adsorption und fraktionierte Desorption ab Aktivkohle oder Zeolithen erfolgen. Isobutan wird in großen Mengen aus n-Butan durch Isomerisierung mit einem Gemisch von Aluminiumchlorid und Chlorwasserstoff als Katalysator hergestellt.[3]
Verwendung
Große Bedeutung haben die Butane als Brenngas (z. B. Feuerzeuggas), Kältemittel (Isobutan: R600a) sowie als Treibgase.[3][4] Gasgemische aus z. B. 40 % Propan und 60 % Butan werden an Tankstellen als Autogas, als Flaschengas für Gas-Rechauds und für technische Geräte zum Löten und Schweißen, als Kartuschen im Campingbereich und als Nachfülldosen für Feuerzeuge usw. verwendet.
Im Winter wird Otto-Kraftstoff (Benzin) mit einem höheren Butangehalt verkauft als im Sommer, da Butan wegen des tiefen Siedepunktes die Kaltstartfreudigkeit des Otto-Motors bei tiefen Außentemperaturen verbessert.
Butane werden vielfältig in der chemischen Industrie zur Darstellung von C4-Alkenen wie 1,3-Butadien, 1-Buten, 2-Buten und Isobuten sowie für Synthesen höherer Kohlenwasserstoffe (für „Alkylatbenzin“), Thiophen sowie von Oxidationsprodukten wie tert-Butylhydroperoxid eingesetzt.
Sicherheitshinweise
Butane besitzen – wie alle Alkane – eine narkotische und sauerstoffverdrängende Wirkung. Bei einer dadurch ausgelösten Atemdepression können Effekte auf das Zentralnervensystem wie Erregung, Euphorie und Erbrechen, bei hohen Dosierungen auch negative Wirkungen auf Blutkreislauf und Herz (wie Herzrhythmusstörungen) auftreten.[4]
Einzelnachweise
- ↑ Eintrag zu Butan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Oktober 2011 (JavaScript erforderlich).
- ↑ Eintrag zu Isobutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Oktober 2011 (JavaScript erforderlich).
- ↑ 3,0 3,1 3,2 Wissenschaft-Online-Lexika: Eintrag zu „Butane“ im Lexikon der Chemie, abgerufen am 17. November 2011.
- ↑ 4,0 4,1 Butane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. November 2011.
| Dieser Artikel basiert ursprünglich auf dem Artikel Butane aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |
