| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
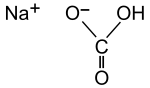
Natriumhydrogencarbonat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Natriumhydrogencarbonat | ||||||
| Andere Namen |
| ||||||
| Summenformel | NaHCO3 | ||||||
| CAS-Nummer | 144-55-8 | ||||||
| Kurzbeschreibung |
farbloser, geruchloser, kristalliner Feststoff[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 84,01 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,22 g·cm−3 (20 °C)[2] | ||||||
| Schmelzpunkt |
Zersetzung ab 50 °C[2] | ||||||
| pKs-Wert | |||||||
| Löslichkeit |
mäßig in Wasser (96 g·l−1 bei 20 °C)[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Toxikologische Daten | |||||||
| Thermodynamische Eigenschaften | |||||||
| ΔHf0 |
−950,8 kJ/mol[4] | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Natriumhydrogencarbonat (Trivialname: Natron) hat die Summenformel NaHCO3, ist ein Natriumsalz der Kohlensäure und zählt zu den Hydrogencarbonaten. Die Verbindung sollte nicht mit Natriumcarbonat (Soda, Summenformel Na2CO3) verwechselt werden. Gelegentlich werden für Natriumhydrogencarbonat auch die veralteten und chemisch unzutreffenden Trivialnamen doppeltkohlensaures Natron und Natriumbicarbonat verwendet. Im Handel wird die Verbindung auch unter den Bezeichnungen Speisesoda, Backsoda, Speisenatron sowie den Markennamen Bullrich-Salz und Kaiser Natron angeboten.[5]
Etymologie
Der Begriff des Natrons existiert seit Beginn der Neuzeit im Deutschen, zuerst in der Form (der) niter, entlehnt über französisch (le) nitre, das wiederum aus lateinisch nitrum, und das aus griechisch nítron (νίτρον) (Herodot; attisch lítron (λίτρον)). Das Griechische greift ein Wort auf, das seit dem 2. Jahrtausend vor Christus in ganz Vorderasien verbreitet war und das Natron bezeichnete. Die heute vorkommenden Begriffe Nitrat, Nitrit, Nitro und dergleichen schöpfen aus dieser Linie.
Im späten 18. Jahrhundert wird diese Form im Deutschen und anderen europäischen Sprachen durch Natron ersetzt, das direkt aus arabisch anatrūn als anatron entlehnt wurde. Der darin enthaltene arabische Artikel wurde später gestrichen. Der Name des Elements Natrium ist davon abgeleitet.
Bereits im Wörterbuch der ägyptischen Sprache wurden vor einem knappen Jahrhundert griechisch nítron (νίτρον) und hebräisch neter mit dem altägyptischen Natronwort nṯr.j verknüpft, das im 2. Jahrtausend vor Christus etwa /natsₑra-/ ausgesprochen wurde. Da sich das Natronwort in dieser Zeit in vielen unverwandten, aber benachbarten Sprachen findet, muss diese Etymologie als wahrscheinlich betrachtet werden.
Ägyptisch nṯr.j bedeutet als Natronwort jedoch nicht 'göttlich' und bezeichnet auch das Natron nicht als göttliche Substanz, wie häufig zu lesen ist. Alle Gegenstände und Substanzen der Vorbereitung des Leichnams für das Begräbnis und der Mumifizierung heißen grundsätzlich nṯr.j, zum Beispiel auch Mumienbinden und Mumifizierungsgeräte, also 'zum Begräbnis gehörende Sache'.
Vorkommen
Natriumhydrogencarbonat kommt als natürliches Mineral Nahcolith in den Vereinigten Staaten vor. Es tritt meist feinverteilt in Ölschiefer auf und kann dann nur als Beiprodukt der Ölförderung gewonnen werden. Ein Bergbau besonders reicher Nahcolith-Horizonte wird im Bundesstaat Colorado betrieben, die jährliche Förderung lag im Jahre 2007 bei 93.440 Tonnen.[6]
Herstellung
Umsetzung von gesättigter Natriumcarbonatlösung mit Kohlenstoffdioxid unter Kühlung:
Dies ist eine Gleichgewichtsreaktion, die aber durch die relative Schwerlöslichkeit von Natriumhydrogencarbonat stark nach rechts verschoben ist. Das abfiltrierte Natriumhydrogencarbonat muss vorsichtig getrocknet werden, damit es sich nicht wieder zersetzt (in Umkehrung der Bildungsreaktion).
Im Solvay-Verfahren als Zwischenprodukt ausfallendes Natriumhydrogencarbonat wird wegen der mitgefällten Verunreinigungen (hauptsächlich Ammoniumchlorid) normalerweise nicht verwendet.
Eigenschaften
Natriumhydrogencarbonat ist ein farbloser, kristalliner Feststoff, der sich oberhalb einer Temperatur von 50 °C unter Abspaltung von Wasser und Kohlenstoffdioxid zu Natriumcarbonat zersetzt.[2]
In Wasser löst es sich im Unterschied zu Soda mit nur schwach alkalischer Reaktion.[7]
Natriumhydrogencarbonat besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c.[8] Die Verbindung bildet Mischkristalle mit Natriumcarbonat.[7]
Verwendung von Natron
Natriumhydrogencarbonat wird hauptsächlich zur Herstellung von Backpulver und Brausepulver verwendet. Die weltweite Produktionsmenge liegt im 100.000 Tonnen Maßstab.[7]
Die Verbindung findet allgemein vielfältige Anwendung:
- In der Lebensmitteltechnik
- Bestandteil von Backpulvern bzw. Triebmittel[2]
- Bestandteil von Brausepulvern[2]
- In der Sportlerernährung[9]
- bei geeigneter Anwendung und Dosierung bei gesunden, trainierten und nicht mangelernährten Menschen kann ein positiver Effekt auf die Ausdauer für belegt oder wahrscheinlich angesehen werden[10]
- In der Medizin
- zum Zähneputzen (Natron bzw. baking soda ist wegen seines abrasiven Effekts in vielen Zahnpasten enthalten, vor allem in Ländern wie den USA)[11]
- als Mittel gegen Sodbrennen wegen der Neutralisationswirkung unter Bildung von ungiftigen Reaktionsprodukten (CO2 und Wasser); gilt heute als veraltet (siehe Antazidum, Protonenpumpenhemmer). NaHCO3 ist dennoch in vielen Produkten gegen Sodbrennen und säurebedingte Magenprobleme enthalten. Beispielsweise besteht das Bullrich-Salz zu 100 % aus Natriumhydrogencarbonat.[7]
- als Antidot bei Vergiftungen durch Barbiturate, Salicylate und Trizyklische Antidepressiva[12]
- zur Behandlung der metabolischen Azidose[13] und Hyperkaliämie[14]
- Laut Schüßler-Salzen bei Insektenstichen[15]
- In der Luftfahrttechnik
- zur Hitzeabsorption in Flugschreibern[16]
- In der Umwelttechnik
- als Absorptionsmittel für saure Abgasbestandteile (SOx, Cl) in Rauchgasreinigungsanlagen (Bicar-Verfahren)[17]
- Historisch zur Dehydratisierung von Leichen (Mumifizierung)
- In der Landwirtschaft
- Bestandteil von Feuerlöschpulvern (Abgabe von CO2 bei Erhitzung[7])
- zum Strecken von synthetischen Drogen wie Amphetamin sowie zur Herstellung von Crack aus Kokain[21]
- Im Haushalt
- als Bestandteil von Feinwaschmitteln[22]
- als Putzmittel zum Entfernen verkrusteter Speisereste: Den Topfboden mit Natron überpudern, stehen lassen und mit Wasser aufkochen. Geeignet für Edelstahl- und Emailletöpfe, Thermoskannen, Teekannen, Blumenvasen.[23]
- Eine Prise Natron im Kochwasser lässt Erbsen, Linsen und Bohnen schneller weich werden und nimmt verschiedenen Kohlsorten die blähende Wirkung.[23]
- Als Beigabe zum fertigen Käsefondue macht es dieses leichter bekömmlich und luftig.
- Es neutralisiert Gerüche: Mundgeruch, Abflussrohre, muffige Schuhe, Kühlschrank, Katzentoilette, Kleintierkäfige.[23]
- Als biologisches Mittel gegen Ameisenplagen: Streut man Natron in die Löcher des Ameisenbaus und auf die Ameisenwege, nehmen die Ameisen das Natron auf und tragen es mit in ihren Bau. Natron ändert den pH-Wert im Körper der Ameisen, was zum Tode führt.[24]
- Überschüssige Säure in Lebensmitteln wird durch Natron neutralisiert oder abgeschwächt.[2] Dies ist etwa bei der Zubereitung von Konfitüren aus sauren Früchten wie Sanddorn oder Rhabarber von Bedeutung, da diese so einen milderen Geschmack erhalten und weniger Zucker verwendet werden muss. Auch zu einer Speise übermäßig zugesetzter Essig oder Zitronensaft kann durch Natron neutralisiert werden.[25]
Bei der Zugabe von Natriumhydrogencarbonat werden aus hartem Wasser Calcium- und Magnesiumionen als Carbonate ausgefällt:[26][25]
Dies gelingt wegen des Gleichgewichtes zwischen Carbonat- und Hydrogencarbonat-Ionen jedoch nur unvollständig.[25]
- In der Aquaristik
- Erhöhung der Pufferkapazität zur Verhinderung eines Säuresturzes
- Anhebung des KH-Wertes in der Meerwasseraquaristik[27]
- In Spielzeugraketen dient es zusammen mit Essig[28] oder Zitronensäure als Treibstoff.[29]
- Im Modellbau kann man bei einem Diorama Schnee darstellen, es dient hier als preiswerte Alternative zu dem im Fachhandel als "Modellschnee" angebotenen Produkten. Man streut es oft auf noch feuchten Klarlack oder Holzleim.
Biologische Bedeutung
Mit Säuren reagiert es schäumend unter Bildung von Kohlenstoffdioxid und Wasser.
- Natriumhydrogencarbonat und Salzsäure reagieren zu Natriumchlorid, Kohlenstoffdioxid und Wasser.
Die Möglichkeit, Säuren durch HCO3− zu neutralisieren, ist für den Körper überlebenswichtig.
- Im Magen muss aufgrund der dort aktiven Enzyme ein saures Milieu herrschen, dies geschieht durch Produktion von Chlorwasserstoff (HCl), woraus sich zusammen mit Wasser der Magensaft (ca. 0,5-prozentige Salzsäure) bildet, deren pH-Wert (nüchtern) bis auf 1–1,5 sinken kann. Die Epithelzellen der Magenwand, die bei einem so niedrigen pH-Wert sofort zugrunde gehen würden, schützen sich selbst durch Abgabe von mit HCO3− versetztem Schleim.[30] Dringen H+-Ionen der Salzsäure in die Schleimschicht ein, so werden sie zu CO2 und Wasser neutralisiert. Das CO2 entweicht zumeist durch die Speiseröhre.
- Im Dünndarm wird wiederum eine alkalische Umgebung benötigt, da hier andere Enzyme die Spaltung der Nährstoffe übernehmen. Die Änderung des pH-Wertes erfolgt im Duodenum durch Einspeisung des Sekretes der Bauchspeicheldrüse, welches unter anderem ebenfalls – wie der im Magen abgegebene Schleim – HCO3− enthält.
- Hydrogencarbonat HCO3− ist der wichtigste Blutpuffer zur Regulierung des Säure-Basen-Haushalts des Menschen.
Einzelnachweise
- ↑ 1,0 1,1 1,2 Datenblatt Natriumhydrogencarbonat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Eintrag zu Natriumhydrogencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Februar 2008 (JavaScript erforderlich).
- ↑ 3,0 3,1 : Thermodynamic quantities for the ionization reactions of buffers in water. (PDF) In: J. Phys. Chem. Ref. Data. 31, Nr. 2, 2002, S. 264. Abgerufen am 16. Juli 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Unser Klassiker ist über 100 Jahre jung.
- ↑ Präsentation des US Geological Survey zu Nahcolith-Vorräten in Colorado (PDF 12 MB, engl.)
- ↑ 7,0 7,1 7,2 7,3 7,4 Arnold F. Holleman: Lehrbuch der anorganischen Chemie. Walter de Gruyter, 1995, ISBN 311012641-9, S. 1182 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ R. L. Sass, R. F. Scheuerman: The crystal structure of sodium bicarbonate. In: Acta Crystallographica. 15, 1962, S. 77–81, doi:10.1107/S0365110X62000158.
- ↑ Michael Stierwald: Zur Wirksamkeit und Sinnhaftigkeit ausgewählter ergogener Substanzen im Sport. Diplomarbeiten Agentur, 2010, ISBN 383664942-X, S. 43 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Sportlerernährung und Sportlernahrung: Eine aktuelle Bestandsaufnahme. Abgerufen am 26. Oktober 2011.
- ↑ Wilfried Umbach: Kosmetik und Hygiene: von Kopf bis Fuß. John Wiley & Sons, 2012, ISBN 352766350-9 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Antidot-Monographie für Natriumhydrogencarbonat(PDF; 60 kB)
- ↑ Wolfgang Hartig: Ernährungs und Infusionstherapie: Standards für Klinik, Intensivstation und .... Georg Thieme Verlag, 2004, ISBN 313130738-2, S. 326 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Franz-Josef Kretz, Karin Becke: Anästhesie und Intensivmedizin bei Kindern - Franz-Josef Kretz, Karin Becke. Georg Thieme Verlag, 2007, ISBN 313157212-4, S. 151 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Günther H. Heepen: Schüßler-Kuren: Heilanwendungen mit den 12 Salzen. Gräfe Und Unzer, 2009, ISBN 383381401-2, S. 120 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ US-Patent. Abgerufen am 18. April 2014.
- ↑ Michael Beckmann, Rudi Karpf, Volker Dütge und Tao Wen: Vergleichende ökonomische Betrachtung verschiedener Einsatzstoffe bei Trockensorptionsverfahren zur Abgasreinigung, abgerufen am 17. Mai 2014
- ↑ oekolandbau.nrw.de: Indirekte Unkrautregulierung in Winterweizen, abgerufen am 17. Mai 2014
- ↑ portal-rind.de: Auswirkungen von Fütterungsfehlern und Stoffwechselstörungen auf die Klauengesundheit :: Portal-Rind.de, abgerufen am 17. Mai 2014
- ↑ Natriumhydrogencarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Mai 2014.
- ↑ Thomas Geschwinde: Rauschdrogen: Marktformen und Wirkungsweisen. Springer DE, 2013, ISBN 364230163-0, S. 530 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Günter Wagner: Waschmittel - Chemie, Umwelt, Nachhaltigkeit. John Wiley & Sons, 2011, ISBN 352764366-4, S. 100 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ 23,0 23,1 23,2 Christa Pöppelmann: SOS. Wie macht man das?: Was man wirklich können muss!. Compact Verlag, 2010, ISBN 381747922-0 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Softkill mit Soda, Artikel von Christoph Drösser auf Zeit Online, 30. April 2009, abgerufen am 16. Juni 2013.
- ↑ 25,0 25,1 25,2 Georg Schwedt: Noch mehr Experimente mit Supermarktprodukten: Das Periodensystem als Wegweiser. John Wiley & Sons, 2012, ISBN 352766139-5 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ seilnacht.com: Natriumhydrogencarbonat (Natron), abgerufen am 17. Mai 2014
- ↑ Bauanleitungen zum Thema Aquarium und Aquaristik: PH-Wert & KH mit Natron erhöhen, abgerufen am 17.Mai 2014
- ↑ TK: Abgehoben: Backpulver-Essig-Rakete, abgerufen am 17. Mai 2014
- ↑ auer-verlag.de: Die Brausepulverrakete, abgerufen am 17. Mai 2014
- ↑ Bikarbonatbatterie, S. E. Miederer, Fortschr Med.1994,Jun 10; 112(16):235–8, PubMed
Weblinks
| Dieser Artikel basiert ursprünglich auf dem Artikel Natriumhydrogencarbonat aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |





