| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
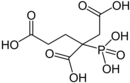
Phosphonate
Phosphonate (veraltet: Phosphite) sind Salze und organische Verbindungen der Phosphonsäure (veraltet: Phosphorige Säure). Als Salze existieren primäre (M'H2PO3) und sekundäre (M'2HPO3) Phosphonate.[1] (M': einwertiges Metall)
Die organischen Verbindungen dieser Stoffgruppe (Phosphorigsäureester) haben die allgemeine Struktur R-PO(OH)2 (R = Alkyl-Rest oder Aryl-Rest) und unterscheiden sich von den Estern der Phosphorsäure durch die direkte Bindung des Phosphors mit Kohlenstoff (C-P-Bindung). Bei Phosphaten liegen hingegen (analog zu Sulfaten und Sulfonen) C-O-P-Bindungen vor, die sich im Vergleich zu C-P-Bindungen viel leichter hydrolysieren lassen. In Verbindungen dieses Typs sind die Eigenschaften eines Salzes (bzw. einer Säure) mit den Eigenschaften von organischen Verbindung verknüpft. So gibt es viele Verbindungen dieses Typs, die in Wasser löslich sind.
Einige technisch wichtige Phosphonate tragen Amino-Gruppe(n) in der Art NR2-(CH2)x-PO(OH)2 (R = alkyl oder H). Einige diese Aminophosphonate haben strukturelle Ähnlichkeiten mit Komplexbildnern wie EDTA, NTA oder DTPA und haben eine ähnliche Funktion. Sie können Kationen wie beispielsweise Ca2+ in der Lösung ummanteln und das chemische Verhalten des Kations verändern. Im Fall von Calcium verschwindet die Eigenschaft Wasserhärte zu bilden. Aber auch andere Kationen können "ummantelt" werden, um damit deren chemische Reaktivität mehr oder weniger abzuschwächen.
Natürliches Vorkommen
1959 wurde mit 2-Aminoethylphosphonsäure die erste natürliche Phosphonsäure identifiziert. Sie kommt in Pflanzen und vielen Tieren vor, vor allem in Membranen. Phosphonate sind weit verbreitet in vielen verschiedenen Organismen, z. B. in Prokaryoten, Eubakterien, Pilzen, Mollusken und Insekten. Die biologische Rolle der Phosphonate ist noch nicht endgültig geklärt. Bis jetzt wurden keine natürlichen Bis- oder andere Polyphosphonate entdeckt.[2]
Technische Anwendungen
Ein wichtiger industrieller Gebrauch von Phosphonaten ist in Kühlwassersystemen, Entsalzungsanlagen und bei der Ölförderung, wo sie die Ausfällung von Salzen verhindern. In der Papier- und Textilindustrie werden sie als Stabilisator für die Peroxidbleiche eingesetzt und komplexieren dort Metalle, welche sonst das Peroxid inaktivieren würden.[2]
In Waschmitteln werden sie als eine Kombination von Komplexbildnern, zur Verhinderung von Ausfällungen und als Bleichmittelstabilisator eingesetzt. Sie können ähnliche Eigenschaften wie EDTA haben und als Ersatz von Pentanatriumtriphosphat dienen. Sie sind Komplexbildner und dienen vor allem als Wasserenthärter. Als Builder können sie den Ionentauscher bzw. den Enthärter Zeolith A als Carrier unterstützen. Sie können als Korrosionsinhibitoren mitwirken oder als Stabilisator für Peroxide (z.B. in Bleichmitteln) dienen.[2]
1998 wurden weltweit etwa 56.000 Tonnen Phosphonate verwendet – 40.000 Tonnen in den USA, 15.000 Tonnen in Europa und weniger als 800 Tonnen in Japan.[2]
Beispiele
Herbizide
Hauptartikel: Glyphosat
Eines der bekanntesten und wirtschaftlich bedeutendsten Phosphonate ist Glyphosat (RoundUp®), ein Herbizid von Monsanto, welches eine Phosphonat-, eine Carboxylat- und eine Aminogruppe enthält.[2]
Toxikologie
Die Toxizität der in den Beispielen genannten Phosphonate ist gering, die LC50-Werte für Fische liegen zwischen 0,1 und 1 mM. Auch werden sie praktisch nicht bioakkumuliert. Diese Phosphonate werden im Magen-Darm-Trakt nur sehr schlecht resorbiert und der größte Teil der absorbierten Menge wird über die Nieren wieder ausgeschieden. Die Humantoxizität dieser Phosphonate ist ebenfalls sehr gering.[2] Phosphonate sind den Phosphaten ähnlich, besitzen jedoch eine C-P-Bindung anstelle einer C-O-P-Bindung. Diese Ähnlichkeit führt häufig dazu, dass Phosphonsäureester Inhibitoren vieler Enzyme sind.
Biologischer Abbau
Bakterien spielen in der Natur eine wichtige Rolle beim Abbau von Phosphonaten. Bakterien, welche die C-P Bindung spalten können, können mit Phosphonaten als alleiniger P-Quelle überleben. Aminophosphonate können von manchen Organismen auch als Stickstoffquelle genutzt werden. Die in der Industrie genutzten Polyphosphonate unterscheiden sich von den natürlichen Phosphonaten, da sie viel größer sind, eine starke negative Ladung tragen und mit Metallen komplexiert sind. Abbautests mit Klärschlamm haben gezeigt, dass HEDP und NTMP nicht abgebaut werden. Auch in Standardtests zeigte sich kein Abbau von HEDP, NTMP, EDTMP und DTPMP. Aus verschiedenen Umweltkompartimenten (Böden, Wasser, Klärschlamm, Kompost) konnten Bakterien isoliert werden, welche unter P-Mangel HEDP abzubauen vermögen. Allgemein bauen Bakterien nur Phosphonate mit einer funktionellen Gruppe ab.[2]
Umweltverhalten
Die in den Beispielen genannten Phosphonate haben einige Eigenschaften, welche sie von anderen Komplexbildnern unterscheiden und welche ihr Umweltverhalten bestimmen. Phosphonate reagieren äußerst stark mit Oberflächen, was zu einer starken Elimination in technischen und natürlichen Systemen durch Adsorption führt, obwohl sie biologisch nicht abbaubar sind. Deswegen führen Phosphonate kaum zu einer Metallmobilisierung in der Umwelt. Der photochemische Abbau von Fe(III)-phosphonaten ist schnell. Aminopolyphosphonate werden in Gegenwart von Mangan(II) und Sauerstoff schnell oxidiert; die stabilen Produkte dieser Reaktion wurden in Kläranlagen identifiziert. Der Mangel an Daten über das Umweltverhalten oder Konzentrationen von Phosphonaten in der Umwelt kommt von analytischen Problemen mit der Spurenanalyse. In natürlichen Wässern kommen Phosphonate hauptsächlich als Ca- und Mg-Komplexe vor.[2]
In der Medizin
Phosphonate werden in der Medizin verwendet, vor allem zur Behandlung von Knochenkrankheiten und von Ca-Metabolismus-Störungen.[2] Unter Bisphosphonaten wird in der Medizin Verbindungen der Phosphonsäure mit der allgemeinen Konstitutionsformel ((O3P)2-C-R1R2)4− verstanden. Sie sind Analoga zu Diphosphaten (Pyrophosphate) (O3P-O-PO3)4− und greifen in die Calcium-Homöostase ein. Sie werden daher unter anderem zur Behandlung der Osteoporose und von Knochenmetastasen eingesetzt.
Synthese
Mono- und Dialkylphosphonate sind über die Michaelis-Arbuzov-Reaktion darstellbar.[3][4] Halogenierte Phosphonate können durch die Michaelis-Becker-Reaktion dargestellt werden.[5] Silylphosphonate können durch eine Kinnear-Perren-Reaktion erzeugt werden.[6]
Literatur
- Philippe Savignac, Bogdan Iorga: Modern Phosphonate Chemistry. CRC Press, 2003, ISBN 0-20350367-8.
Einzelnachweise
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 794–795.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Eugenia Valsami-Jones: Phosphorus in Environmental Technology: Principles and Applications. IWA Publishing, 2004, ISBN 978-1-84339001-5, S. 149 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Timothy Carl Radsick: The Use of Functionalized Monoalkyl Phosphates and Phosphonates in the .... ProQuest, 2007, ISBN 978-0-54939821-9, S. 36 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Abraham Clearfield, Konstantinos D. Demadis: Metal Phosphonate Chemistry: From Synthesis to Applications. Royal Society of Chemistry, 2011, ISBN 978-1-84973356-4, S. 172 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Robert Engel: Handbook of organophosphorus Chemistry. CRC Press, 1992, ISBN 0-82478733-1, S. 280 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Philippe Savignac, Bogdan Iorga: Modern Phosphonate Chemistry. CRC Press, 2003, ISBN 0-20350367-8, S. 521 (Eingeschränkte Vorschau in der Google Buchsuche).
| Dieser Artikel basiert ursprünglich auf dem Artikel Phosphonate aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |