| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Zahnkaries
Portal:Zahnmedizin – Übersicht zu Wikipedia-Inhalten zum Thema Zahnmedizin
| Klassifikation nach ICD-10 | ||
|---|---|---|
| K02.- | Zahnkaries | |
| ICD-10 online (WHO-Version 2013) | ||
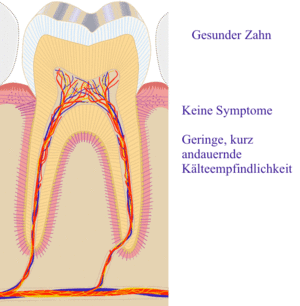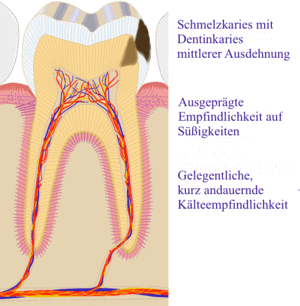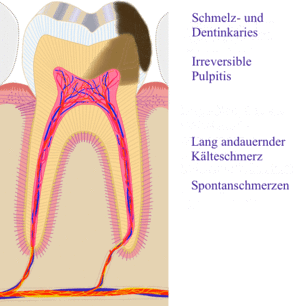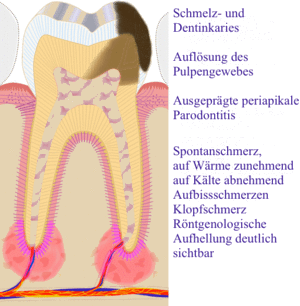
Die Zahnkaries (von lateinisch caries ‚Morschheit‘, ‚Fäulnis‘; auch Zahnfäule oder Zahnfäulnis; Fachausdruck Caries dentium) ist eine Erkrankung der Zahnhartgewebe Zahnschmelz und Dentin.
Ätiologie
Es gibt mehrere Theorien zur Entstehung von Karies. Ausgangspunkt war die chemoparasitäre Theorie nach Willoughby D. Miller (1890), wonach Lactobazillen bis in die 60er Jahre als Ursache angesehen wurden.[1] In der Folge entwickelte sich die spezifische Plaquehypothese, gefolgt von einem Paradigmenwechsel, der zur ökologischen Plaquehypothese geführt hat.[2] Demnach kommt es auf Grund mehrerer pathogener Faktoren zur Zerstörung der Zahnhartgewebe in mehreren Stufen.
Karies wird durch eine Störung der Homöostase der oralen Mikroflora, nämlich durch eine selektive Begünstigung potenziell pathogener Mikroorganismen wie des Streptococcus mutans und durch eine zuckerreiche Ernährung verursacht. Dadurch führt nicht eine exogene Infektion der für Karies verantwortlichen pathogenen Spezies zur Karies. Die Bakterien sind auch bei Gesunden ein Teil der physiologischen endogenen Flora und wirken nur durch qualitative und quantitative Veränderungen pathologisch. Wenn eine azidogene und azidurische Spezies begünstigt wird und deren metabolische Aktivität durch häufigen Zuckerkonsum organische Säuren bildet, führt dies wiederum zu einer Begünstigung der Demineralisation der Zahnhartsubstanzen und damit zur Karies.[3]
Die Mundhöhle eines Ungeborenen ist zunächst steril, bereits bei der Geburt erfolgt der erste Kontakt mit vaginalen und fäkalen Mikroorganismen. Innerhalb kurzer Zeit entwickelt sich eine natürliche Bakterienflora ähnlich der Erwachsener. Die Übertragung der kariogenen Erreger erfolgt durch Speichelkontakt. Der bedeutendste kariogene Keim Streptococcus mutans ist jedoch erst nach Durchbruch der Milchzähne nachzuweisen. Die häufigste Übertragung erfolgt über den Milchflaschensauger zwischen Mutter und Kind (Löffel oder Schnuller abschlecken, Vorkosten, Temperaturprüfung der Milch), aber auch durch andere Übertragungswege wie Küssen, gemeinsames Benutzen von Geschirr, Husten.
Biologische Grundlagen
Die Zähne sind von einem Biofilm (Plaque) umgeben, der zahlreiche Säure bildende Mikroorganismen enthält. Diese verstoffwechseln Kohlenhydrate aus der Nahrung zu Säuren. Diese können wiederum Kalziumphosphate aus dem Schmelz lösen. Wird dieser Prozess nicht gestoppt oder umgekehrt, führt die Entmineralisierung des Schmelzes zur Bildung einer kariösen Läsion. Karies ist das Ergebnis einer ökologischen Veränderung des Biofilms. Sie kann somit als Verschiebung des dynamischen Gleichgewichtes zwischen den in der Zahnhartsubstanz gebundenen Mineralsalzen und denjenigen, die im Biofilm beziehungsweise im Speichel gelöst sind, definiert werden.[4]
An Karies kann man erkranken, wenn fünf Hauptfaktoren zusammenwirken:
- kariogene Bakterien
- Wirtsfaktoren (Zähne, Mineralqualität, Speichelfaktoren, Verhalten)
- Plaque
- niedermolekulare Kohlenhydrate (besonders in Zucker und gezuckerten Speisen enthalten)
- genügend Zeit
Neben diesen Hauptfaktoren gibt es diverse Nebenfaktoren: Zahnstellung, Zahnfehlbildungen, Speichelfluss und -zusammensetzung, genetische Faktoren und die Zusammensetzung der Nahrung.
In der Plaque siedeln sich Laktobazillen und verschiedene Streptokokkenarten an. Herausragend ist Streptococcus mutans. Diese Mikroorganismen produzieren aus niedermolekularen Kohlenhydraten organische Säuren, die den Zahn angreifen, indem sie die in der Zahnhartsubstanz vorhandenen Mineralien herauslösen. Zucker aus der Nahrung wird dabei zu Milchsäure abgebaut. Nur Mikroorganismen, die diesen Stoffwechselprozess beherrschen (azidogene Mikroorganismen) und in stark saurem Milieu überleben können (azidurische Mikroorganismen), vermehren sich dann weiter. Zahnbeläge von Personen, die viel und häufig Zucker konsumieren, haben deshalb eine andere Mikrobiota.
Zusammenspiel des Streptococcus mutans mit Candida albicans
Neuere Forschung hat ergeben, dass ein Zusammenspiel des Streptococcus mutans mit dem Pilz Candida albicans existiert, wodurch das Bakterium seine Virulenz verändert. Der Pilz produziert Signalmoleküle, die Gene des Bakteriums zur Produktion zelleigener Antibiotika anregen. Ferner kann das Bakterium durch den Pilz fremdes Erbgut aufnehmen. Auch die Produktion klebriger Substanzen, einer wichtigen Voraussetzung für die Haftung des S. mutans auf dem Zahn, wird durch den Pilz unterdrückt.[5]
Neutralisierung der Säuren
Von großer Wichtigkeit für die Zahngesundheit sind ausreichende Pausen zwischen den Mahlzeiten (oder dem Trinken zuckerhaltiger Getränke), in denen der Speichel die Säuren neutralisieren und die angegriffene Zahnsubstanz remineralisieren kann. Es kommt also nicht so sehr auf die Menge des konsumierten Zuckers an, sondern vor allem auf die Häufigkeit und Dauer des Zuckerkonsums. Eine über den Tag verteilte Dosis eines zuckerhaltigen Erfrischungsgetränkes erhöht das Kariesrisiko beträchtlich, da dadurch dem Zahnschmelz die Regenerationsphasen genommen werden. Ein ausreichender Speichelfluss ist für die Gesunderhaltung von Zähnen und Mundschleimhäuten unerlässlich. Jede Beeinträchtigung des Speichelflusses bedeutet neben einer Vielzahl von unangenehmen Begleiterscheinungen auch immer eine Erhöhung des Kariesrisikos. Ein gänzliches Versiegen des Speichelflusses kann innerhalb kürzester Zeit zur kariösen Zerstörung der Zähne führen.
Stadien
Stadien der Karies reichen von der Initialkaries über die Dentinkaries bis zur Caries penetrans. Sie werden mittels spezieller Sonden diagnostiziert.
Initialkaries
Als Kariesvorstufe (Initialkaries) bilden sich zuerst Entkalkungen. Diese sind makroskopisch als weiße Flecken (englisch white spot, lat. macula alba) erkennbar. Durch Einlagerungen von Farbpigmenten aus der Nahrung werden diese Flecken oft dunkel (lat. macula fusca).
Karies, welche sich nur auf den Schmelz begrenzt, muss nicht in jedem Fall behandelt werden. Solange die Schmelz-Schicht nur angegriffen, aber insgesamt noch intakt ist, kann durch geeignete Fluoridierungsmaßnahmen und eine Änderung der Ernährung (nach Ernährungsberatung) die Läsion remineralisiert werden, dabei werden die Hydroxidionen im Apatit durch das Fluorid zu Fluorapatit ersetzt.
Wird eine Karies im Anfangsstadium, d. h. solange nur der Zahnschmelz (Caries superficialis) befallen ist, nicht remineralisiert, dringt sie in das Dentin (Zahnbein) vor. Bereits diese Dentinkaries (Caries media) kann zu Zahnschmerzen führen.
Da Dentin wesentlich weicher als Zahnschmelz ist, breitet sich die Karies unterhalb der Schmelz-Dentin-Grenze in die Breite aus. Der so unterminierte Zahnschmelz an den Rändern des kariösen Defektes bricht nach gewisser Zeit beim Kauen ein. Die Karies wird da oft erstmals wahrgenommen, obwohl sie schon seit längerer Zeit existiert.
Caries profunda
Die Caries profunda (lat. tiefe Zahnkaries) bedeutet, dass die Kariesläsion bis über 2/3 der Dentinschicht in Richtung der Pulpa vorgedrungen ist. Die Läsion besteht dann
- aus der Destruktionsschicht, in der Bakterien nicht nur Mineral aufgelöst, sondern auch die Proteinmatrix zersetzt haben,
- der Zone der bakteriellen Penetration, in der Bakterien in die Dentinkanälchen eingedrungen sind,
- der Demineralisationszone (Mineralverlust durch Säureeinwirkung)
- und der Transparenzzone. In dieser haben die Odontoblasten mehr Mineral in den Dentinkanälchen abgelagert, um den Fortschritt der Karies zu verzögern. Im mikroskopischen Dünnschliff erscheint diese Schicht durchsichtig, da die optischen Grenzflächen (mineralisiertes Dentin und Kanalinhalt) wegen der Mineralablagerung verschwunden sind.
Caries penetrans
Bei der Caries penetrans (durchdringende Zahnfäule) hat der Defekt durch das Dentin hindurch die Pulpa (im Volksmund: „Zahnnerv“) erreicht, so dass eine Verbindung zwischen Mundhöhle und Pulpencavum (Hohlraum, in dem sich die Pulpa befindet) entstanden ist.
Vorkommen
In Deutschland ist nur etwa ein Prozent der Erwachsenen kariesfrei, hat also naturgesunde Zähne. Die Vierte Deutsche Mundgesundheitsstudie (DMS IV; 2010)[6] ergab, dass 70,1 % der Kinder (12 Jahre) und 46,1 % der Jugendlichen (15 Jahre) ein Gebiss ohne Karieserfahrung haben.
Karies nach Strahlentherapie
Erkranken Patienten an malignen Tumoren im Kopf-Hals-Bereich, so kommt in etwa 50 Prozent der Fälle ionisierende Strahlung zur Tumorelimination zum Einsatz (Strahlentherapie). Obwohl die heute übliche fraktionierte Bestrahlung die Folgen einer Strahlentherapie auf die Speicheldrüsen etwas einschränkt, gibt es bisher keine zuverlässige Methode, die Strahlung so zu beherrschen, dass Nebenwirkungen vollkommen ausgeschlossen werden können. Betroffen sind Haut und Schleimhaut, Muskulatur, Speicheldrüsen, Knochen und Zähne. Eine Schädigung der Speicheldrüsen führt zu Mundtrockenheit, auch radiogene Xerostomie genannt, in deren Folge eine oft sehr schmerzhafte Entzündung der Mundschleimhaut (Mukositis) auftreten kann. Das Risiko einer sogenannten Strahlenkaries (Caries radiatio) steigt bei diesen Patienten durch den Wegfall der neutralisierenden und remineralisierenden Wirkung des Speichels extrem an.
Um das Risiko einer Strahlenkaries zu verringern, sollte vor Beginn der Radiotherapie eine vollständige Sanierung des Gebisses erfolgen. Außerdem sollten bereits in dieser Phase die Zahnpflege und die Kooperationsbereitschaft des Patienten durch umfangreiche und wiederholte Mundhygieneinstruktionen verbessert werden. Während der Bestrahlungsphase muss täglich eine professionelle Mundreinigung durchgeführt werden.[7] Zur Verminderung von Strahlenschäden an den Mundschleimhäuten können Strahlenschutzschienen eingesetzt werden. Doch Mundhygienemaßnahmen alleine können das Auftreten der Strahlenkaries nicht verhindern. Auch Speichelersatzmittel sind als ein wertvolles zusätzlich einsetzbares Mittel anzusehen, haben aber keine kariesprophylaktische Wirkung. Sie können im Gegenteil sogar Schäden an der Zahnhartsubstanz hervorrufen, da sie zum Teil einen niedrigen pH-Wert haben und damit erosiv wirken. Die regelmäßige lokale Fluoridierung während und nach der Bestrahlung ist daher zentrale Begleittherapie für Kopf-Hals-bestrahlte Patienten.
Weitere Hinweise:
- DGZMK (Deutsche Gesellschaft für Zahn-, Mund- und Kieferheilkunde) und DEGRO (Deutsche Gesellschaft für Radioonkologie, Medizinische Physik und Strahlenbiologie): Gemeinsame Empfehlung zur Zahnärztlichen Betreuung von Patienten mit tumortherapeutischer Kopf-Hals-Bestrahlung (2002)
- Handtmann S, Mühlbradt L, Hoffmann J, Reinert S. Prophylaxe und Therapie – Bestrahlungsbedingte Nebenwirkungen I: Schädigungen der Zahnhartsubstanz. ZBW (2005) 42–47
Folgen und Komplikationen
Da die Kariesläsion sich der Pulpa nähert, können bakterielle Endotoxine zur Entzündung der Pulpa führen. Der Patient nimmt das durch erhöhte Kälte- und Wärmeempfindlichkeit wahr, da die Endotoxine die Reizschwelle der Nervenfasern herabsetzen. In diesem Stadium kann durch eine zahnärztliche Behandlung die Entzündung rückgängig gemacht werden (Entfernen der Karies, Anbringen einer bakterienhemmenden Unterfüllung (auf der Basis von Ca(OH)2) und einer dichten Restauration). Wird der Entzündungsvorgang nicht unterbrochen, kann die Pulpa unwiderruflich angegriffen werden (irreversible Pulpitis), es kommt zu spontanen, zum Teil heftigen Schmerzen einer odontogenen Infektion. Erreichen die Bakterien die Pulpa, entstehen lokale Abszesse, und die Pulpa stirbt ab (Pulpengangrän). In diesem Fall hilft nur noch eine Wurzelkanalbehandlung oder, wenn der Zahn nicht mehr restauriert werden kann, die Extraktion.
Bildet sich an bereits behandelten (gefüllten) Stellen erneut Karies, so spricht man vom Kariesrezidiv oder der Sekundärkaries. Bei der Sekundärkaries handelt es sich um eine kariöse Erkrankung durch jegliche restaurative Maßnahme, beispielsweise an einem überstehenden, unpolierten oder schadhaften Füllungs- oder Kronenrand.
Vorbeugung
Die beste Möglichkeit, Karies vorzubeugen, ist eine Beschränkung der Zuckeraufnahme. Dadurch wird die Veränderung der Mundflora in Richtung einer kariogenen Plaque verhindert. Die American Dental Association (US-amerikanische Zahnärztliche Vereinigung)[8] und die Europäische Kinderzahnärztliche Akademie[9] empfehlen, den Konsum zuckerhaltiger Getränke einzuschränken sowie Säuglingen und Kleinkindern keine zuckerhaltigen Flüssigkeiten zum Einschlafen zu geben. Es gibt außerdem Hinweise darauf, dass unraffinierter Vollrohrzucker weniger kariös wirkt.[10]
Eine Studie der University of Pennsylvania ergab zudem, dass der Hefepilz Candida albicans zu einer Förderung der Plaqueproduktion führt und somit das Kariesrisiko erhöht. Versuche mit Ratten zeigten eine Häufung von Zahnschäden durch die Kombination der Hefepilze und Streptokokken.[11]
Stevia, auch für Diabetiker geeignet, hat eine plaquehemmende Wirkung und ist darum vorbeugend gegen Karies und damit zahnfreundlich.
Als gute Möglichkeit, die Entstehung von Karies zu verhindern, wird die Prophylaxe mit Fluorid angesehen. Fluorid fördert die Remineralisation, härtet die oberste Schmelzschicht und hemmt das Bakterienwachstum. Als Vorbeugung für ganze Bevölkerungsgruppen wurde in der Vergangenheit die Fluoridierung des Trinkwassers diskutiert. Wegen der unterschiedlichen Gewohnheiten gibt es jedoch Bedenken wegen möglicher Überdosierung und Nebenwirkungen. Auch der Zusatz von Fluoriden im Speisesalz kommt zur Anwendung.
Daneben kann eine gründliche Entfernung der Zahnbeläge die Demineralisation verhindern. Kurz nach den Mahlzeiten sollte diese nicht erfolgen, da der Zahnschmelz bereits angelöst ist und durch das Reinigen leichter abgetragen werden kann. Als Hilfsmittel können Chemotherapeutika wie Fluoride und Chlorhexidin verwendet werden. Zusätzlich sind ein Ersatz von Zucker durch Xylitol (auch Xylit genannt), die Versiegelung der Fissuren, regelmäßige Kontrollen beim Zahnarzt und natürlich die regelmäßige Zahnreinigung gute Optionen, um sich vor Karies zu schützen. Dabei ist die einzige Möglichkeit, die Plaque zuverlässig zu entfernen, die Reinigung der Zähne mit der Zahnbürste und in den Zahnzwischenräumen mit Zahnseide oder, bei größeren Abständen zwischen den Zähnen, mit der Zahnzwischenraumbürste. Mundspülungen, auch Chlorhexidindigluconat, können eine Neubildung der Plaque verzögern, aber nicht verhindern.
Vor allem in Finnland wurde seit den 1970er-Jahren der Einsatz von Xylit systematisch erforscht. Dabei wurde belegt, dass Xylit nicht nur die Kariesbildung nachhaltig hemmt, sondern auch zu einer Remineralisierung der betroffenen Zahnbereiche führen kann. Die antikariogene Wirkung wird dadurch erklärt, dass die kariogenen Streptococcus mutans das Xylit nicht verstoffwechseln können und damit absterben. Weiterhin werden sie auch daran gehindert, als Plaquebakterien an der Zahnoberfläche anzuheften. Als optimal wurde in den finnischen Studien eine Xylitmenge zwischen 5 und 10 Gramm pro Tag in mehreren Portionen ermittelt. Dies kann mittels Kaugummi oder Lutschpastillen erfolgen. Darüber hinaus regt Xylit die Speichelproduktion an und fördert die Bildung von Komplexen mit Calcium und Speicheleiweißen in der Mundhöhle, was zu einer Remineralisation von Zahnhartsubstanz führt.
Polyphenole aus roten Weintrauben hemmen die Bakterienart Streptococcus mutans, die zum Aufbau von Zahnbelägen (Plaque) und sogenannten Biofilmen auf den Zähnen beiträgt. Durch ihre bakterizide Wirkung hemmen Polyphenole die schädlichen Auswirkungen der Bakterien und wirken so auch vorbeugend gegen Zahnfäule und Zahnkaries.[12]
Ein völlig neuer Ansatz zur Kariesprophylaxe ist ein effizientes Bakterienmanagement, das sich am Bakterientiter (Konzentration) im Speichel orientiert, sich diesem anpasst und dafür sorgt, dass sich die Bakterienkonzentration im Mund konstant in der physiologisch sinnvollen Konzentration einregelt. Dafür werden antibakterielle Wirkstoffdepots im Mund platziert, die mit einem für die Bakterienzellteilung notwendigen Stoff (Lecithin) umhüllt werden. Bakterien, die in die Zellteilungphase eintreten, nutzen das Lecithin des Wirkstoffdepots zum Aufbau einer neuen Zellhülle (Zellgrenzschicht). Dabei werden die antibakteriellen Inhaltsstoffe der Wirkstoffdepots freigesetzt, die Bakterienzellteilung verhindert und der Keimtiter im Mund auf ein konstantes Niveau eingestellt.[13]
Eine weitere neuartige Entwicklung ist die Verwendung von speziellen Milchsäurebakterien, zum Beispiel als Hauptbestandteil von Zahnpasta: der Lactobacillus paracasei gegen Karieserreger.[14] Diese sind in der Lage, Kariesbakterien gezielt zu erkennen, an diesen anzudocken und danach leicht zu entfernen.
Es wird empfohlen, zweimal im Jahr zum Zahnarzt zu gehen, damit dieser den Zustand der Zähne kontrolliert. Dabei sollte gegebenenfalls Plaque und Zahnstein entfernt werden. Eine umfassende Prophylaxe wird durch die Professionelle Zahnreinigung (PZR) erreicht. Einige Zahnärzte bieten auch die Fluoridierung der Zahnoberfläche als Vorbeugung an. Zahnschmerz kommt als Warnsignal oft zu spät.
Durch den weitverbreiteten Gebrauch von Fluoriden beobachtet man heutzutage das Phänomen der „verborgenen Karies“. Kleine Kavitäten in den Fissuren oder Zahnzwischenräumen breiten sich in Richtung des Dentins aus, ohne zu einer nennenswerten Schädigung der Schmelzschicht zu führen. Dadurch bleibt lange Zeit bei flüchtiger Untersuchung der Eindruck eines gesunden Gebisses. Röntgenaufnahmen sind inzwischen eine zuverlässigere Diagnosetechnik.
Therapie
Die Entkalkung („macula alba“) als Vorstufe der Karies lässt sich durch intensive Fluoridierung mit speziellen Fluoridpräparaten remineralisieren und so zum Verschwinden bringen.
Kariesinfiltration
Eine neuartige Behandlungsmethode, die Kariesinfiltration, soll beginnende approximale Karies oder beginnende Flächenkaries ohne „Bohren“ stoppen. Das Prinzip der Kariesinfiltration beruht auf der Penetration eines niedrig viskösen Kunststoffs (Infiltranten) in den Läsionskörper einer Karies. Nach Aushärtung verschließt der Infiltrant die Läsionsporen und stellt somit eine Diffusionsbarriere für Säuren und niedermolekulare Kohlenhydrate dar.[15][16][17]
Konservative Therapieformen
Spätere Stadien der Karies, die mit einer Kavität („Loch“) einhergehen, müssen anders versorgt werden: Die betroffene Zahnhartsubstanz muss ausgeräumt und der Zahn mit einem Füllungsmaterial (beispielsweise Komposit, Amalgam, Goldinlay oder Porzellaninlay) versorgt werden.
Bei stärkerer Zerstörung des Zahnes kommt eine Überkronung, ggf. eine Wurzelkanalbehandlung oder eine Entfernung des Zahnes in Frage. Der entfernte Zahn sollte möglichst umgehend ersetzt werden (Brücke oder Implantat), um Veränderungen des Kiefers bzw. der Zahnstellung zu verhindern.
Belassen kariösen Restdentins
Nach einhundert Jahren, in denen die vollständige Entfernung kariösen Dentins als State-of-the-art galt, wird nach neueren Untersuchungen dem Belassen von kariösem Restdentin im pulpennahen Bereich der Vorzug gegeben. Im Mittelpunkt der Behandlung pulpennaher Defekte steht der Erhalt der verschlossenen Pulpa. Eine komplette Kariesentfernung führt häufiger zur Eröffnung der Pulpa als das Belassen von Restkaries im ein- oder zweizeitigen Verfahren. Dem pulpennahen Dentin wird dabei Gelegenheit gegeben Sekundärdentin zu bilden. Pulpennahes Dentin sollte mit Kalziumhydroxid oder Glasionomerzement abgedeckt werden. Das Verfahren wird − oft eher aus Marketinggründen − als minimalinvasiv bezeichnet. Um kariöses Dentin im notwendigen Umfang exkavieren zu können, gibt es zahlreiche selbstlimitierende Verfahren.
Diese arbeiten entweder mit aktivem Feedback:
- Fluorescence Aided Caries Excavation (FACE)
- drehmomentkontrollierte Bohrer
- fluoreszenzgesteuerter Laser
oder mit passivem Feedback:
- chemomechanisch: Carisolv
- proteolytische Enzyme
- rotierende Polymerinstrumente
Aktive Feedback-Verfahren sind zu bevorzugen, da sich dabei der gewünschte Endpunkt des Exkavierens einstellen lässt und der Zustand des verbleibenden Dentins berücksichtigt werden kann.[18] Nach einer aktuellen Studie mit hoher Evidenz wird die Prognose der Pulpa durch unvollständige Kariesentfernung in einem Schritt, also mit anschließendem definitivem Kavitätenverschluss, verbessert.[19]
Erbliche Veranlagung
Es gibt seltene vererbte Krankheitsbilder. Beispielsweise die Amelogenesis imperfecta, eine angeborene Störung der Zahnschmelzbildung, die mit einer erhöhten Kariesanfälligkeit einhergeht.
Siehe auch
- Erosion (Zahnmedizin)
- Meth-Mund
- Nursing-Bottle-Syndrom (Kariesentstehung durch dauerhaftes Nuckeln an Saugflaschen bei Kindern)
- Zahnverlust
Literatur
- S3-Leitlinie Fluoridierungsmaßnahmen zur Kariesprophylaxe der Dt. Ges. f. Zahn-, Mund- und Kieferheilkunde. In: AWMF online (Stand 02/2013)
- Hayes C. (2001): The effect of non-cariogenic sweeteners on the prevention of dental caries: a review of the evidence. In: J Dent Educ. Bd. 65, S. 1106–1109. PMID 11699985 PDF
- Kauko K. Mäkinen: Der Einsatz von Xylit in der Kariesprophylaxe. pdv Praxis-Dienste und Verlag, Heidelberg 2003, ISBN 3-935802-09-9
- Strübig, Wolfgang (2005): Xylit und Kaugummi – eine ideale kariespräventive Kombination? In: Dentalhygiene Journal. Nr. 4, S. 33–37.
- Z. Gintner, J. Szöke, A. Patthy, E. Söderling, J. Banoczy (2004): Wirkung von Xylit-Pastillen auf Zahnplaque und Streptococcus mutans. In: Oralprophylaxe & Kinderzahnheilkunde. Bd. 26, S. 93–95. PDF
Weblinks
Einzelnachweise
- ↑ Willoughby D. Miller: The microorganisms of the human mouth. S. S. White and Co, Philadelphia 1890 (Reprinted, Karger Basel 1973)
- ↑ P. D. Marsh: Dental diseases–are these examples of ecological catastrophes? In: International journal of dental hygiene. Band 4 Suppl 1, September 2006, S. 3–10, ISSN 1601-5029. doi:10.1111/j.1601-5037.2006.00195.x. PMID 16965527.
- ↑ O. Fejerskov: Changing paradigms in concepts on dental caries: consequences for oral health care. In: Caries research. Band 38, Nummer 3, 2004 May-Jun, S. 182–191, ISSN 0008-6568. doi:10.1159/000077753. PMID 15153687. (Review)
- ↑ G. Allais, Karies, Die biologischen Faktoren (PDF; 130 kB) Bayerisches Zahnärzteblatt 03/2008, S. 50–58
- ↑ elena Sztajer, Szymon P Szafranski, Jürgen Tomasch, Michael Reck, Manfred Nimtz, Manfred Rohde, Irene Wagner-Döbler, Cross-feeding and interkingdom communication in dual-species biofilms of Streptococcus mutans and Candida albicans,The ISME Journal (2014) 8, 2256–2271; doi:10.1038/ismej.2014.73; 13 Mai 2014. Abgerufen am 18. November 2015.
- ↑ | Deutsche Mundgesundheitsstudie (DMS IV; 2010) (PDF-Datei; 191 kB)
- ↑ W. Dörr, J. Haagen, Behandlung der oralen Mukositis in der Onkologie
- ↑ Oral Health Topics: Baby Bottle Tooth Decay, hosted on the American Dental Association website. Page accessed August 14, 2006
- ↑ A Guide to Oral Health to Prospective Mothers and their Infants, hosted on the European Academy of Paediatric Dentistry website. Page accessed August 14, 2006
- ↑ M.-H. Béguin: Natürliche Nahrung – gesunde Zähne. Edition de l'Etoile 1979. Violette Béguin. La Chaux-de Fonds.
- ↑ M. L. Falsetta, M. I. Klein u. a.: Symbiotic Relationship between Streptococcus mutans and Candida albicans Synergizes Virulence of Plaque Biofilms In Vivo. In: Infection and immunity. Band 82, Nummer 5, Mai 2014, S. 1968–1981, ISSN 1098-5522. doi:10.1128/IAI.00087-14. PMID 24566629.
- ↑ Hyun Koo et al.: Chemical characterization of red wine grape (Vitis vinifera and Vitis interspecific hybrids) and pomace phenolic extracts and their biological activity against Streptococcus mutans. In: Journal of Agricultural and Food Chemistry, Band 55 , Nr. 25, 2007, S. 10200–10207. PMID 17999462 (Siehe auch: Polyphenole aus Weintrauben wirken gegen Bakterien, die Karies auslösen können)
- ↑ http://www.liporal.de/
- ↑ BASF pro-t-action™ Lactobazillus anti-caries für die Mundhygiene
- ↑ H. Meyer-Lueckel, O. Fejerskov, S. Paris: [Novel treatment possibilities for proximal caries]. In: Schweizer Monatsschrift für Zahnmedizin = Revue mensuelle suisse d'odonto-stomatologie = Rivista mensile svizzera di odontologia e stomatologia / SSO. Band 119, Nummer 5, 2009, S. 454–461, ISSN 0256-2855. PMID 19579836. (Review).
- ↑ S. Paris, H. Meyer-Lueckel: Inhibition of caries progression by resin infiltration in situ. In: Caries Research. Band 44, Nummer 1, 2010, S. 47–54, ISSN 1421-976X. doi:10.1159/000275917. PMID 20090328.
- ↑ F. Schwendicke, S. Seddig: Micro-hardness and mineral loss of enamel lesions after infiltration with various resins: influence of infiltrant composition and application frequency in vitro. In: Journal of Dentistry. Band 41, Nummer 6, Juni 2013, S. 543–548, ISSN 1879-176X. doi:10.1016/j.jdent.2013.03.006. PMID 23571098.
- ↑ K.-H. Kunzelmann, J. H. Koch, Kariesexkavation, Neue Erkenntnisse und selbstlimitierende Methoden zm 101, Nr. 13 A, 1. Juli 2011, (1860)
- ↑ D. Ricketts, T. Lamont, Operative caries management in adults and children. In: The Cochrane database of systematic reviews. Band 3, 2013, S. CD003808, ISSN 1469-493X. doi:10.1002/14651858.CD003808.pub3. PMID 23543523. (Review).
| Bitte den Hinweis zu Gesundheitsthemen beachten! |
| Dieser Artikel basiert ursprünglich auf dem Artikel Zahnkaries aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |