| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Keimbildung

Keimbildung oder Nukleation ist der erste Teilprozess, der einen Phasenübergang erster Ordnung einleitet. Beispiele hierfür sind das Gefrieren von Wasser zu Eis, Blasenbildung beim Übergang von der flüssigen zur gasförmigen Phase (z. B. beim Öffnen einer Wasserflasche mit gelöstem Kohlendioxid) oder die Kondensation eines Gases.
Allgemeines
Wesentliches Merkmal der Keimbildung ist, dass die neue, bei den gegebenen Bedingungen thermodynamisch stabile Phase, zunächst durch Keime aus der alten, metastabilen Phase ausgebildet wird. Die Bildung dieser typischerweise nur nanometergroßen Keime ist zunächst kinetisch gehemmt. Flüssigkeiten lassen sich unterkühlen und überhitzen. Der Grund für diese Hemmung liegt in der Arbeit, die aufgebracht werden muss, um die gekrümmte Oberfläche eines kleinsten Keims (z. B. ein kugelförmiges Tröpfchen) der neuen Phase zu bilden. Für kleinste Tröpfchen oder Kristalle ist diese Oberflächenarbeit größer als der Energiegewinn aus dem Übergang in die neue, stabile Phase. Die daraus entstehende freie Energiebarriere nennt man Keimbildungsbarriere. Die Arbeit, die aufgebracht werden muss, um diese Barriere zu überwinden, nennt man Keimbildungsarbeit. Der Bereich des Phasendiagramms, in dem die Keime unterhalb der kritischen Keimgröße bleiben, wird auch Ostwald-Miers-Bereich genannt. Sind jedoch einmal Keime, die größer sind als die sogenannte kritische Keimgröße, aus thermischen Fluktuationen gebildet, so wachsen sie schnell zur makroskopischen Phase an. Keimbildung kann damit auch als Prototyp eines aktivierten Prozesses verstanden werden.
Die Keimbildungsrate beschreibt, wie viele Keime der neuen Phase pro Volumen- und Zeiteinheit gebildet werden. Diese Keimbildungsrate hängt stark exponentiell von der Keimbildungsarbeit ab. Je höher die Keimbildungsarbeit und damit die Barriere zur Keimbildung, desto niedriger die Rate.
Keimbildung ist ein allgegenwärtiger Prozess. So erfährt z. B. die von einem Vulkan ausgestoßene Lava einen schlagartigen Temperatur- und Drucksturz und bildet so die typischen, von kleinen Gasbläschen durchsetzten Gesteine. Ein anderes Beispiel sind Wetterphänomene wie die Bildung von Regen, Nebel und Schnee. In der Medizin kennt man z. B. die Taucherkrankheit, die durch zu schnelles Auftauchen verursacht wird. Hier wird der zuvor im Blut gelöste Stickstoff durch den Druckabfall ausgegast. Auch für die Industrie ist die Kenntnis der Keimbildungskinetik von höchstem Interesse, z. B. um den Tropfenschlag in Gasturbinen oder den Siedeverzug in Verdampfern zu verhindern oder die Bildung des Kondensstreifens bei Düsenflugzeugen zu kontrollieren.
Die Nukleation spielt darüber hinaus eine zentrale Rolle in der Verfahrenstechnik von Polymeren, Legierungen sowie manchen Keramiken, aber auch bei der Kontrolle bzw. Verhinderung der Kristallisation (z. B. bei Halbleitermaterialien, metallischen Gläsern oder Honig) und ist darüber hinaus von großer Bedeutung in der Meteorologie.
Nukleationsprozesse werden wegen ihrer großen technischen Relevanz seit dem Beginn des zwanzigsten Jahrhunderts systematisch untersucht. Substantielle Ergebnisse liegen jedoch bisher vor allem für den Phasenübergang gasförmig-flüssig, Kristallisation sowie für die Gefügeänderung in wenigen Metallen vor. Die hierfür aufgestellten Theorien werden mangels Alternative häufig auf die restlichen Systeme übertragen.
Die nach wie vor vorherrschende Theorie ist die sogenannte klassische Keimbildungstheorie (classical nucleation theory)[1][2][3][4][5] Diese wird aufgrund ihrer einfachen Struktur häufig verwendet, obwohl insbesondere für den gasförmig-flüssig Übergang wiederholt gezeigt werden konnte, dass die Vorhersage der Theorie typischerweise um mehrere Größenordnungen abweicht.
Jüngste Untersuchungen des gasförmig-flüssig Phasenübergangs von Argon zeigen z. B. Abweichungen zur klassischen Keimbildungstheorie von mehr als 20 Größenordnungen.[6][7] Abweichungen dieser Größenordnung zwischen Theorie und Experiment sind nahezu einzigartig in der gegenwärtigen Naturwissenschaft. Diese Tatsache ist umso erstaunlicher, als es sich im Wesentlichen um ein Problem der klassischen Physik handelt.
Electrofreezing ist ein Verfahren, durch das die Kristallisation von Wasser und anderen Flüssigkeiten beim Gefrierprozess gezielt durch das Anlegen eines elektrischen Feldes ausgelöst werden kann. Dieses physikalische Phänomen ist seit 1861 bekannt.
Klassische Keimbildungstheorie
Die klassische Keimbildungstheorie macht einige grundlegende, vereinfachende Annahmen, die eine Beschreibung des Keimbildungsprozesses ermöglichen. Ein Großteil dieser Näherungen lässt sich unter dem Begriff ‚Kapillaritätsnäherung‘ zusammenfassen: Mit dieser Näherung wird angenommen, dass auch die kleinsten (mikroskopischen) Keime bereits die gleichen (makroskopischen) Eigenschaften der neuen Phase besitzen. Zur Veranschaulichung der klassischen Keimbildungstheorie wird im Folgenden das Beispiel der Kondensation eines Tröpfchens aus einer übersättigten Gasphase verwendet. In diesem Fall wird der Prozess üblicherweise bei konstanter Temperatur betrachtet, und die treibende Kraft für die Keimbildung ist die Übersättigung.
Thermodynamischer Aspekt
Bei einer übersättigten Gasphase ist bei der gegebenen Temperatur der aktuelle Druck höher als der Gleichgewichtsdampfdruck . Die reversible Arbeit, die notwendig ist, um aus dieser übersättigten Gasphase ein flüssiges Tröpfchen zu formen, lässt sich berechnen. Dazu wird ein Prozess bei konstantem Druck , konstantem Volumen und konstanter Teilchenzahl betrachtet. Das relevante thermodynamische Potential ist also die freie Gibbs-Energie:
Konkret für eine reine Dampfphase (Index v) ergibt sich:
- .
Für ein System, das sowohl Dampf als auch ein flüssiges Tröpfchen (index l), bestehend aus Teilchen, enthält, ergibt sich gleichermaßen
- ,
wobei die Oberflächenspannung eines Tröpfchens mit der Oberfläche ist. Die Keimbildungsarbeit für ein Tröpfchen der Größe in der Gasphase ist nun gerade die Differenz der freien Gibbs Energie eines Systems, das ein Tröpfchen der Größe und Dampf enthält, sowie dem reinen Dampfsystem, . Daraus folgt:
- .
In dieser Gleichung ist gerade die Differenz der chemischen Potentiale des Dampfes und der Flüssigkeit. Die klassische Keimbildungstheorie macht nun eine ganze Reihe von vereinfachenden Annahmen:
- Das flüssige Tröpfchen ist kugelförmig, inkompressibel und hat eine scharfe Grenzfläche.
- Das flüssige Tröpfchen hat die gleiche Oberflächenspannung, Dichte und Dampfdruck wie die makroskopische (flache) flüssige Phase.
- Der Dampfdruck kann mit Hilfe des idealen Gasgesetzes beschrieben werden.
Mit Hilfe dieser Annahmen lässt sich nun die Oberfläche und die Differenz der chemischen Potentiale (mit Hilfe der Gibbs-Duhem-Gleichung) leicht berechnen:
- ,
sowie
- .
Hier ist die Übersättigung, der mittlere Oberflächenbedarf eines Moleküls, ist der Radius des Tröpfchens und ist das mittlere Volumen eines Moleküls in der flüssigen Phase. Damit ergibt sich für die Keimbildungsarbeit
- .
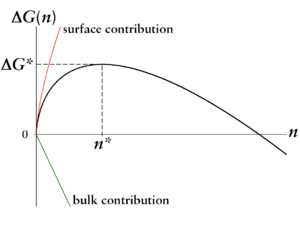
Der erste Term, auch Volumenterm genannt, ist also proportional zu . Dieser Term ist verbunden mit dem Gewinn an Energie aus dem Übergang eines Moleküls aus der metastabilen Dampfphase in die stabile flüssige Phase. Auf der anderen Seite ist der zweite Term jedoch verbunden mit der Arbeit, die aufgebracht werden muss, um die Oberfläche eines solchen flüssigen Tröpfchens zu formen. Dieser Term ist gerade proportional zu . Für - und nur für diesen Fall kann Keimbildung einsetzen - zeigt sich, dass der Oberflächenterm für kleine Tröpfchengrößen dominiert bis zu einer kritischen Größe, ab der der Volumenterm Oberhand gewinnt. Dies ergibt das bekannte Bild einer Barriere in der freien Energie .
Das Maximum ist die Keimbildungsarbeit, die aufgebracht werden muss, um ein Tröpfchen der kritischen Größe zu bilden. Diese kritische Größe und Keimbildungsarbeit sind die bestimmenden Größen der Keimbildung: Tröpfchen, die kleiner als sind, haben eine höhere Wahrscheinlichkeit, wieder zu verdampfen, als weiter zu wachsen, da für diese ein Verdampfen mit einem Gewinn an freier Energie verbunden ist. Nur Tröpfchen größer als haben eine höhere Wahrscheinlichkeit, weiter zu wachsen als zu verdampfen, und können damit als Keime der neuen Phase dienen. Damit ist nun verständlich, warum eine Substanz für längere Zeit metastabil gehalten werden kann: Obwohl die neue Phase (in unserem Beispiel die flüssige Phase) die thermodynamisch stabile Phase ist, muss der Prozess zunächst einige energetisch ungünstige Schritte durchlaufen, um die Barriere zu erklimmen. Die Barriere und die kritische Keimgröße nach der klassischen Keimbildungstheorie sind gerade:
und
Kinetik der Keimbildung
Um nun eine Keimbildungsrate , also die Anzahl der pro Volumen und Zeit gebildeten Keime, zu berechnen, muss ebenfalls die Kinetik der Keimbildung betrachtet werden. Die stationäre Keimbildungsrate wird üblicherweise in Form eines Arrhenius-Ansatzes berechnet:
Der Vorfaktor wird üblicherweise der kinetische Vorfaktor genannt. Auf diesen wird hier jedoch nicht näher eingegangen. Die Höhe der Barriere hat üblicherweise aufgrund der exponentiellen Abhängigkeit einen wesentlich größeren und entscheidenden Einfluss auf die Keimbildungsrate.
Homogene Keimbildung
Erfolgt die Nukleation im freien Raum, also durch ein statisches Zusammentreffen von Teilchen, spricht man von einer homogenen Keimbildung.
Hierzu ist es notwendig, dass sich im Falle der Kondensation ausreichend viele und langsame Teilchen ohne weitere Hilfe zu größeren Strukturen zusammenfinden. Langsame Teilchen können durch das gleichzeitige Zusammentreffen von mehr als zwei Teilchen (Dreierstoß) entstehen. Hierbei nimmt ein Teilchen einen Großteil der kinetischen Energie auf und hinterlässt zwei langsame Teilchen. Die Übersättigung ist dabei ungefähr proportional zur Wahrscheinlichkeit eines derartigen Dreierstoßes, der zur Nukleation führt. Abhängig von dem betrachteten System können daher thermodynamisch metastabile Systeme sehr lange in diesem Zustand verharren.
Heterogene Keimbildung
Im Gegensatz dazu benötigt man bei der heterogenen Keimbildung nur sehr geringe Übersättigungen von oft sogar unter einem Prozent. Diese Form der Kondensation erfolgt wiederum im Fall der Kondensation an bereits existierenden Oberflächen, also im Regelfall an in der Gasphase schwebenden festen Partikeln, den Kondensationskernen bzw. Aerosolteilchen. Diese fungieren in Bezug auf das jeweilige Gas als eine Art Teilchenfänger, wobei im Wesentlichen der Radius und die chemischen Eigenschaften des Partikels bestimmen, wie gut die Gasteilchen an ihm haften bleiben. Analog gilt dies auch für Oberflächen nicht partikulärer Körper, wobei man dann von einem Beschlag spricht. In jedem Falle wirken heterogene Teilchen oder Oberflächen als ein Katalysator für die Keimbildung, indem sie die Keimbildungsbarriere deutlich verringern.
Einzelnachweise
- ↑ M. Volmer and A. Weber: Tröpfchenbildung in Dämpfen, Z. Phys. Chem. (Leipzig) Bd. 119, S. 227, 1926
- ↑ L. Farkas: Keimbildungsgeschwindigkeit in übersättigten Dämpfen, Zeitschr. f. physik. Chemie, Bd. 125, S. 236, 1927 PDF
- ↑ R. Becker, W. Döring: Kinetische Behandlung der Keimbildung in übersättigten Dämpfen, Ann. Phys. Bd. 24, S. 719, 1935, doi:10.1002/andp.19354160806
- ↑ D. Kashchiev, Butterworth-Heinemann (Hrsg.): „Nucleation: Basic Theory With Applications“, 2000, ISBN 0-7506-4682-9
- ↑ P. G. Debenedetti, Princeton University Press (Hrsg.): „Metastable Liquids: Concepts and Principles“, 1996
- ↑ Alexander Fladerer, Reinhard Strey: Homogeneous nucleation and droplet growth in supersaturated argon vapor: The cryogenic nucleation pulse chamber. In: The Journal of Chemical Physics. 124, 2006, S. 164710, doi:10.1063/1.2186327.
- ↑ A. Fladerer: „Keimbildung und Tröpfchenwachstum in übersättigtem Argon-Dampf: Konstruktion einer kryogenen Nukleationspulskammer“, Cuvillier-Verlag, Göttingen (2002), ISBN 3-89873-494-3. PDF
Weblinks
- The Extreme Diet Coke & Mentos Experiments (en) – angewandte Nukleation
| Dieser Artikel basiert ursprünglich auf dem Artikel Keimbildung aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |