| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Ammoniumnitrat
| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
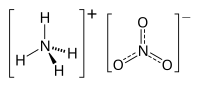
| ||||||||
| Allgemeines | ||||||||
| Name | Ammoniumnitrat | |||||||
| Andere Namen |
| |||||||
| Summenformel | NH4NO3 | |||||||
| CAS-Nummer | 6484-52-2 | |||||||
| PubChem | 22985 | |||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||
| Eigenschaften | ||||||||
| Molare Masse | 80,04 g·mol−1 | |||||||
| Aggregatzustand |
fest | |||||||
| Dichte |
1,72 g·cm−3 (20 °C)[1] | |||||||
| Schmelzpunkt | ||||||||
| Siedepunkt | ||||||||
| Löslichkeit | ||||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Thermodynamische Eigenschaften | ||||||||
| ΔHf0 |
−366 kJ·mol−1[5] | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Ammoniumnitrat ist das Salz, das sich aus Ammoniak und Salpetersäure bildet. Es wird insbesondere zur Herstellung von Düngemitteln und Sprengstoffen verwendet.
Herstellung
Ammoniumnitrat (NH4NO3) entsteht durch Neutralisation von Ammoniak mit Salpetersäure.
Die Reaktion verläuft mit einer Reaktionswärme von −146 kJ·mol−1 stark exotherm.[3]
Eigenschaften
Physikalische Eigenschaften
Ammoniumnitrat bildet farblose hygroskopische Kristalle, die bei 169,6 °C schmelzen. Der Feststoff kann in fünf verschiedenen polymorphen Kristallformen vorliegen, mit Umwandlungstemperaturen bei −16,9 °C, 32,3 °C, 84,2 °C und 125,2 °C.[3][6] Für die Neigung von Ammoniumnitrat-Kristallen zum Zusammenbacken sind dabei namentlich die ersten beiden Phasenumwandlungen in Nähe der Raumtemperatur verantwortlich. Die polymorphen Formen treten in verschiedenen Kristallgittern auf:
Kristallgitter der Modifikationen[3] Polymorph I 169,6 °C … 125,2 °C kubisch Polymorph II 125,2 °C … 84,2 °C tetragonal Polymorph III 84,2 °C … 32,2 °C orthorhombisch Polymorph IV 32,2 °C … −16,9 °C orthorhombisch Polymorph V < −16,9 °C tetragonal
Der Phasenübergang zwischen den Polymorphen IV und III bei 32,2 °C ist bei der Handhabung, aber auch bei der Lagerung der Substanz relevant. In Formulierungen für Düngemittel oder Sprengstoffe kann dieses Verhalten zu unerwünschten Änderungen der Morphologie und damit der Eigenschaften führen. Durch Dotierung mit verschiedenen Salzen kann dieser Phasenübergang unterdrückt werden, um sogenanntes phasenstabilisiertes Ammoniumnitrat zu erhalten. Geeignete Salze können verschiedene Kaliumsalze, wie Kaliumfluorid, Kaliumchlorid, Kaliumnitrat, Kaliumcarbonat, Kaliumsulfat, Kaliumrhodanid und Kaliumdichromat sein, die allerdings mit einem Anteil von 1 bis 2 Ma% (Massenprozent) zugesetzt werden müssen.[7] Der Effekt kann auch mit einer wesentlich geringeren Menge von 0,1 Ma% Kaliumhexacyanidoferrat(II) K4[Fe(CN)6]·3H2O erreicht werden.[8][9]
Mit der hygroskopischen Eigenschaft des Ammoniumnitrats ist eine starke Schmelzpunktabsenkung verbunden: Schon eine Wasseraufnahme von nur 1 Ma% senkt den Schmelzpunkt des Salzes auf etwa 156 °C. Umgekehrt zeigt das Phasendiagramm bei einem Ammoniumnitratgehalt von 42 Ma% ein Eutektikum mit einem Schmelzpunkt von −16,9 °C.[3] – das in Wasser sehr leicht lösliche Ammoniumnitrat bewirkt also bis zu einem Gehalt von 42 Ma% eine Schmelzpunkterniedrigung des Wassers, worauf seine Anwendung u. a. in Kältemischungen beruht.[10] Bei höheren Massenanteilen liegt das Ammoniumnitrat in zwei Phasen vor, zum einen der wässrigen Lösung, zum anderen dem Salz selbst als festem Bodensatz (bei 20 °C ab ca. 65 Ma%, bei 100 °C ab ca. 91,5 Ma%):
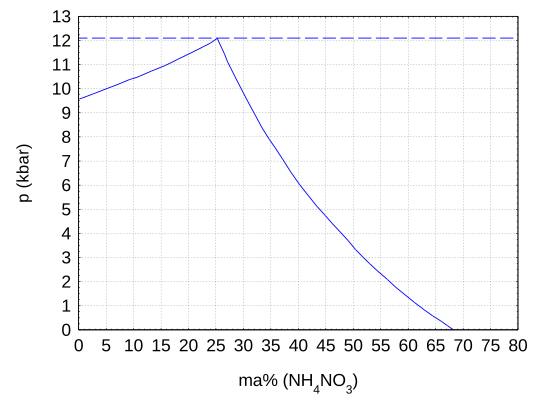
Bei hohem Druck sinkt die Wasserlöslichkeit drastisch: Bei Normaldruck und 25 °C enthält das Gemisch noch 67,6 Ma% Ammoniumnitrat, bis zu einem Druck von 12 kbar sinkt dieser Anteil auf nur noch 25,4 Ma%.[2] Bei einem Druck von 12,1 kbar und einem Gehalt von 25,3 Ma% schneiden sich die Phasengrenzlinien zwischen der einphasigen Lösung und dem zweiphasigen Gemisch aus Lösung und Eis bzw. aus Lösung und Ammoniumnitrat als Polymorph IV.[2] Oberhalb dieses Druckes liegt ein zweiphasiges Gemisch aus Eis und festem Ammoniumnitrat vor und es kann keine Lösung mehr existieren.
Die Dichte von reinem Ammoniumnitrat beträgt 1,725 g·cm−3.[3] In wässriger Lösung steigt die Dichte mit steigender Konzentration bzw. sinkt mit steigender Temperatur.[3]
Dichte von wässrigen Ammoniumnitratlösungen bei verschiedenen Temperaturen[3] Gehalt (Ma%) 20 % 30 % 40 % 50 % 60 % 70 % 80 % 90 % 94 % 20 °C 1,0830 1,1275 1,1750 1,2250 1,2785 40 °C 1,0725 1,1160 1,1630 1,2130 1,2660 1,3220 60 °C 1,0620 1,1045 1,1510 1,2005 1,2525 1,3090 1,3685 80 °C 1,0550 1,0935 1,1390 1,1875 1,2395 1,2960 1,3550 100 °C 1,0410 1,0820 1,1270 1,1745 1,2265 1,2825 1,3420 1,4075 120 °C 1,3285 1,3930 1,4210 140 °C 1,3785 1,4065 160 °C 1,3940
In Methanol ergeben sich bei 30 °C eine 20-%ige bzw. bei 60 °C eine 40-%ige Lösung.[3] Die Löslichkeit in Ethanol ist wesentlich geringer. Hier kann bei 20 °C nur eine 4-%ige Lösung erhalten werden.[3]
Chemische Eigenschaften
Beim Erhitzen (T > 170 °C) zerfällt Ammoniumnitrat gemäß der Gleichung[11]
in Wasser und Lachgas. Durch starke Initialzündung zerfällt es folgendermaßen:
Das Stickstoffatom des Nitrat-Ions NO3− (Oxidationsstufe +V) oxidiert dabei das Stickstoffatom des Ammonium-Ions NH4+ (Oxidationsstufe −III), so dass sich am Ende, im N2-Molekül, beide Stickstoffatome auf gleicher Oxidationsstufe (hier 0) befinden. Reaktionen dieser Art, bei denen Atome andere Atome desselben Elements oxidieren und dabei selbst reduziert werden, so dass sich am Ende alle auf gleicher Oxidationsstufe befinden, heißen Komproportionierungen.
Der explosionsartige Übergang vom Feststoff (NH4NO3) zu ausnahmslos gasförmigen Produkten (H2O, N2 und O2) dieser Reaktion erklärt die hohe Sprengkraft des Ammoniumnitrats: Mit etwa 980 l/kg[6] besitzt es eines der höchsten spezifischen Schwadenvolumen, und kalkuliert man auch noch seine Dichte mit ein, ergibt sich ein sogar noch höheres Verhältnis (Schwadenvolumen/Sprengstoffvolumen). Weitere wichtige Explosionskennzahlen sind:[6]
- Explosionswärme: 2625 kJ·kg−1
- Detonationsgeschwindigkeit: 2500 m·s−1 bei einer Dichte von 1,4 g·cm−3
- Bleiblockausbauchung: 180 cm3/10 g
- Schlagempfindlichkeit: 49 N·m
- Reibempfindlichkeit: Bis 353 N Stiftbelastung keine Reaktion
- Stahlhülsentest: Grenzdurchmesser 1,0 mm
Durch Reaktion mit konzentrierter Schwefelsäure und anschließender Destillation lässt sich die Salpetersäure zurückgewinnen, welche die Ausgangssubstanz zur Herstellung vieler Explosivstoffe ist:
Verwendung
Ammoniumnitrat ist Hauptbestandteil vieler Düngemittel (Ammoniumnitrat-Harnstoff-Lösung, Mehrnährstoffdünger („Blaukorn“), Kalkammonsalpeter (Nitramoncal, Markenname der Chemie Linz, intern NAC)).
Außerdem wird es für Sprengstoffe genutzt. Ammoniumnitrat ist beispielsweise in den Sprengmitteln ANC, Donarit und Kinepak enthalten.
Auch als Treibmittel für Airbags in Kraftfahrzeugen wurde Ammoniumnitrat zeitweise verwendet. Es erwies sich allerdings insbesondere unter dem Einfluss von hoher Umgebungstemperatur und Luftfeuchtigkeit als nicht ausreichend langzeitstabil und wurde durch andere Treibmittel abgelöst.[12] Allein in den USA mussten über 40 Millionen Fahrzeuge zurückgerufen werden, weil mindestens ein Airbag einen Gasgenerator mit Ammoniumnitrat enthielt.[13]
Obwohl es als brandfördernd gilt und beim Erhitzen explodieren kann, gehört Ammoniumnitrat nicht zu den eigentlich explosionsgefährlichen Stoffen im Sinne des Sprengstoffgesetzes.[6] Gleichwohl wird der Umgang mit ihm in der Bundesrepublik Deutschland durch das Sprengstoffgesetz geregelt, und so darf Ammoniumnitrat wegen seiner möglichen Gefährlichkeit in Düngemitteln inzwischen nur noch gemischt mit harmlosen Stoffen wie Kalk verwendet werden (KAS27). Typische Konzentrationen beim Hersteller Chemie Linz waren ehemals 26 und 28 % N (Stickstoffgehalt). Heute üblich ist 27 % N, was etwa 70 % NH4NO3 und Rest Kalk sowie etwas Öl gegen das Zusammenbacken der Kugeln bedeutet. Höhere Stickstoffgehalte bis 46 % sind durch Harnstoff realisierbar, sein Amidstickstoff ist langsamer verfügbar.
Katastrophen
Ammoniumnitrat ist die Ursache zahlreicher Explosionskatastrophen:[14]
- Explosion des Oppauer Ammoniakwerkes bei BASF in Ludwigshafen am 21. September 1921: Festgewordener Ammoniumsulfatnitrat-Dünger wurde dort üblicherweise vor dem Ausschleusen mittels Dynamit aufgelockert. Aufgrund einer Änderung des Produktionsverfahrens kam es vermutlich zu einer lokalen Anreicherung von Ammoniumnitrat im Produkt. Durch die Sprengungen wurden zwei kurz aufeinanderfolgende Explosionen ausgelöst, bei denen in einem Silo ca. 400 von insgesamt 4500 Tonnen Düngemittel detonierten und so einen der größten Explosionsschäden der Geschichte verursachten: 559 Menschen wurden getötet, 1977 verletzt und ein großer Teil der Fabrik sowie der umliegenden Bebauung wurden zerstört.[15] Die Explosion war bis in das 300 Kilometer entfernte München zu hören.[16]
- Bei der Texas-City-Explosion am 16. April 1947 explodierten im Hafen von Texas City in den Vereinigten Staaten die beiden mit Ammoniumnitrat beladenen Frachter Grandcamp (Frankreich) und Highflyer (USA). Es gab 500 bis 600 Tote,[17] über 100 Vermisste, 8000 Verletzte, Hunderte Obdachlose und 65 Millionen US-Dollar Schaden.
- Am 28. Juli 1947 explodierte im Hafen von Brest (Frankreich) der mit Ammoniumnitrat beladene Frachter Ocean Liberty (Norwegen). Es gab 26 Tote und über 100 Verletzte.[18][19]
- Am 9. Januar 1963 kam es in Oulu (Finnland) zu einer Explosion in einer Stickstofffabrik, bei der 10 Angestellte starben.[20][21]
- Beim Bombenanschlag auf das Murrah Federal Building in Oklahoma City am 19. April 1995 in den USA ermordete der rechtsextreme Terrorist Timothy McVeigh 168 Menschen, darunter 19 Kinder in einem Kindergarten, und verletzte mehr als 800 weitere Personen, indem er eine Autobombe mit einem von ihm selbst hergestellten, 2,4 Tonnen schweren Sprengsatz aus Ammoniumnitrat und Nitromethan zur Detonation brachte und damit ein achtstöckiges Verwaltungsgebäude zum Einsturz brachte. Über 300 weitere Gebäude wurden beschädigt.
- Genau 80 Jahre nach der Explosion des Oppauer Ammoniakwerkes (siehe oben) starben am 21. September 2001 bei einer Ammoniumnitrat-Explosion in der Düngemittelfabrik AZF im französischen Toulouse 31 Menschen. Auch hier gab es darüber hinaus tausende Verletzte und riesige Sachschäden.
- Beim Eisenbahnunfall von Ryongchŏn am 22. April 2004 kam es im nordkoreanischen Ryongchŏn zur Explosion eines mit Ammoniumnitrat beladenen Zugwaggons, bei der mindestens 161 Menschen starben. Schätzungsweise 1300 Menschen wurden verletzt und 8000 Häuser zerstört oder beschädigt.
- Am 22. Juli 2011 brachte der rechtsextreme Attentäter Anders Behring Breivik als Teil seiner Anschlagsserie in Norwegen im Osloer Regierungsviertel eine Autobombe auf Basis von 950 Kilogramm ANFO (Ammoniumnitrat und Dieselöl) zur Explosion. 8 Menschen kamen ums Leben, 10 weitere wurden verletzt.
- Bei einem Brand und einer heftigen Explosion in der West Fertilizer Company in Texas am 17. April 2013 starben mindestens 14 Menschen und 180 weitere wurden verletzt.[22][23]
- Am 12. August 2015 wurden bei einer Explosion im chinesischen Tianjin hunderte Menschen getötet bzw. verletzt. Laut der britischen Zeitung The Guardian waren vor Ort neben zahlreichen anderen Substanzen 800 Tonnen Ammoniumnitrat gelagert.[24] Diese Menge ist geeignet, den ca. 100 m breiten Krater zu erklären, den die Explosion hinterließ. Welche Substanz den Hauptanteil an der Zerstörung hatte, ist nicht bekannt.
- Am 4. August 2020 zerstörte nach Angaben des libanesischen Ministerpräsidenten eine Menge von ca. 2750 Tonnen Ammoniumnitrat in einer gewaltigen Explosion den Hafen der Stadt Beirut sowie weite Teile der Umgebung. Die Explosion war so heftig, dass sie noch hunderte Kilometer weit zu hören war.[25]
Siehe auch
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Eintrag zu Ammoniumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017 (JavaScript erforderlich).
- ↑ 2,0 2,1 2,2 L. H. Adams, R. E. Gibson: Equilibrium in binary systems under pressure. III. The influence of pressure on the solubility of ammonium nitrate in water at 25°. In: J. Am. Chem. Soc.. 54, Nr. 12, 1932 ISSN 0002-7863, S. 4520-4537, doi:10.1021/ja01351a008.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 Karl-Heinz Zapp, Karl-Heinz Wostbrock, Manfred Schäfer, Kimihiko Sato, Herbert Seiter, Werner Zwick, Ruthild Creutziger, Herbert Leiter: Ammonium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30673-2, Ammonium Compounds, doi:10.1002/14356007.a02_243.
- ↑ Gaylord Chemical Company, L.L.C (Hrsg.): Dimethyl Sulfoxide (DMSO) Solubility Data. In: Bulletin 102. 2014-06 S. 15 (gaylordchemical.com, abgerufen am 6. August 2020).
- ↑ Frank-Michael Becker u. a: Formelsammlung. 3. Auflage. Paetec, Berlin 2003, ISBN 3-89818-700-4, S. 116.
- ↑ 6,0 6,1 6,2 6,3 Rudolf Meyer, Josef Köhler, Axel Homburg, Rudolf Meyer, Axel Homburg,: Explosivstoffe. 10., vollst. überarb. Auflage. Wiley VCH, Weinheim 2008, ISBN 978-3-527-62341-9.
- ↑ C. Oommen, S. R. Jain: Phase Modification of Ammonium Nitrate by Potassium Salts. In: Journal of Thermal Analysis and Calorimetry. 55, Nr. 3, 1999 ISSN 1572-8943, S. 903–918, doi:10.1023/A:1010146203523.
- ↑ Anuj A. Vargeese, Satyawati S. Joshi, V. N. Krishnamurthy: Use of potassium ferrocyanide as habit modifier in the size reduction and phase modification of ammonium nitrate crystals in slurries. In: Journal of Hazardous Materials. 180, Nr. 1, 2010 ISSN 0304-3894, S. 583–589, doi:10.1016/j.jhazmat.2010.04.073 (sciencedirect.com).
- ↑ Anuj A. Vargeese, Krishnamurthi Muralidharan, V. N. Krishnamurthy: Thermal stability of habit modified ammonium nitrate: Insights from isoconversional kinetic analysis. In: Thermochimica Acta. 524, Nr. 1, 2011 ISSN 0040-6031, S. 165–169, doi:10.1016/j.tca.2011.07.009 (sciencedirect.com).
- ↑ Bernd Engels, Reinhold Fink, Tanja Schirmeister, Carsten Schmuck: Chemie für Mediziner. 1. Auflage. Addison Wesley in Pearson Education Deutschland, München 2008, ISBN 978-3-8273-7286-4.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 65 ([1] in der Google Buchsuche).
- ↑ Neil Gough, Jonathan Soble, Hiroko Tabuchi: Defective Takata Airbag Grows Into Global Problem for Manufacturer. In: New York Times online. 18. November 2014, abgerufen am 14. April 2019 (english).
- ↑ Takata Airbag Recall: Everything You Need to Know. In: Consumer Reports. 29. März 2013, abgerufen am 16. April 2019 (english).
- ↑ Hans Schuh:: Das Rätsel von Toulouse. In: Die Zeit. Nr. 41, 2001 S. 39 (Review über Ammoniumnitratkatastrophen., zeit.de).
- ↑ Christian Haller: Das Explosionsunglück in der BASF vom 21. September 1921. Katastrophenwahrnehmung und -verarbeitung in Presse, Politik und Fachwelt. In: Zeitschrift für die Geschichte des Oberrheins. Nr. 161, 2013 S. 327–328.
- ↑ R. M. Goody: The Physics of the Stratosphere. Cambridge University Press, 2014, ISBN 978-1-107-69606-8, S. 32 (Volltext in der Google Buchsuche).
- ↑ Aftermath. (Memento vom 26. November 2015 im Internet Archive) In: The 1947 Texas City Disaster. Moore Memorial Public Library, 2. April 2007 (englisch).
- ↑ Emina Mamaca u. a.: Review of Chemical Spills at Sea and Lessons Learnt. 2009, S. 17 (Interspill-Konferenz des Centre of Documentation, Research and Experimentation on Accidental Water Pollution).
- ↑ Sébastien Panou: 28 juillet 1947, l'Ocean Liberty explose. In: maville.com. brest.maville.com, 28. Juli 2007, abgerufen am 6. August 2020 (français).
- ↑ Kohtalokkaasta tehdasräjähdyksestä 55 vuotta – koko Oulun kaupunki vavahteli ja uhreja on vieläkin kateissa. Abgerufen am 8. August 2020 (suomi).
- ↑ Kun Typpi räjähti, koko Oulu heräsi – oululaisten mieleen syöpyneen Typpi Oy:n räjähdyksen aiheutti sama ammoniumnitraatti kuin Beirutin räjähdyksen. Abgerufen am 8. August 2020 (suomi).
- ↑ Deadly Texas blast 'like tornado'. In: BBC News. BBC News, 2013-04-18 (bbc.com).
- ↑ Düngerwerk in Texas: Explosion hinterlässt Bild der Verwüstung. In: orf.at. news.ORF.at, 13. April 2013, abgerufen am 6. August 2020.
- ↑ Fergus Ryan: Tianjin explosions: warehouse 'handled toxic chemicals without licence' – reports. In: The Guardian. 2015 ISSN 0261-3077 (theguardian.com).
- ↑ Beirut: Woher stammt das gefährliche Ammoniumnitrat? In: tagesschau.de. Abgerufen am 6. August 2020.
Literatur
- Ausschuss für Gefahrstoffe (Hrsg.): Technische Regel für Gefahrstoffe. TRGS 511 Ammoniumnitrat. (PDF; 431 kB). November 2008
- Richard Escales: Ammonsalpetersprengstoffe. Books on Demand, Norderstedt 2002, ISBN 3-8311-3563-0 (Nachdruck der Ausgabe von 1909)
- K. Hahnefeld, R. Gill, G. Buske: Einflußgrößen auf Detonationsfähigkeit von Ammoniumnitrat. Wirtschaftsverlag NW, Bremerhaven 1983, ISBN 3-88314-308-1
- W. Pittman, Zhe Han, B. Harding, C. Rosas, Jiaojun Jiang, A. Pineda, M. S. Mannan: Lessons to be learned from an analysis of ammonium nitrate disasters in the last 100 years. In: J. Hazard. Mat. 280, 2014, S. 472–477, doi:10.1016/j.jhazmat.2014.08.037
| Dieser Artikel basiert ursprünglich auf dem Artikel Ammoniumnitrat aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |