| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Magnesiumcarbonat
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
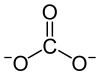
| |||||||||
| Allgemeines | |||||||||
| Name | Magnesiumcarbonat | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | MgCO3 | ||||||||
| CAS-Nummer |
| ||||||||
| PubChem | 11029 | ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 84,31 g·mol−1[2] | ||||||||
| Aggregatzustand |
fest | ||||||||
| Dichte |
2,96 g·cm−3 (20 °C)[2] | ||||||||
| Schmelzpunkt |
> 350 °C (Zersetzung)[2] | ||||||||
| Löslichkeit |
sehr schwer löslich in Wasser (0,106 g·l−1 bei 20 °C)[2] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| MAK |
Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub)[3] | ||||||||
| Thermodynamische Eigenschaften | |||||||||
| ΔHf0 |
−1095,8 kJ/mol[4] | ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Magnesiumcarbonat, MgCO3 ist eine anorganische chemische Verbindung.
Vorkommen
Magnesiumcarbonat kommt in der Natur in großen Mengen als Magnesit (Bitterspat) (MgCO3) mit der Härte 4–4½ vor. Es ist neben Dolomit das wichtigste Magnesium-Mineral. Ebenfalls bekannt sind die Minerale Barringtonit MgCO3·2 H2O, Nesquehonit (MgCO3·3 H2O) und Lansfordit MgCO3·5 H2O.
Gewinnung und Darstellung
Magnesiumcarbonat fällt aus Magnesiumsalzlösungen mit Alkalimetallcarbonaten aus, jedoch nur bei Kohlendioxid-Überschuss. Anderenfalls entstehen basische Carbonate wie das „Magnesia alba“.[5]
Amorphes kristallwasserfreies Magnesiumcarbonat, sogenanntes Upsalit, konnte erst jüngst durch eine Niedertemperatur-Synthese dargestellt werden und weist eine hohe spezifische Oberfläche von 800 m²/g MgCO3 auf.[6] Bis dahin waren nur Synthesen bei erhöhter Temperatur bekannt, was in der Literatur als „Magnesit-Problem“ bekannt ist.[7]
Eigenschaften
Das kristallwasserhaltige neutrale Magnesiumcarbonat geht, besonders in der Wärme, in basisches Magnesiumcarbonat über:
Magnesiumcarbonat ist zusammen mit Calciumcarbonat (Kalk) hauptsächlich für die Entstehung der Wasserhärte verantwortlich. Es kristallisiert trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167), mit den Gitterparametern a = 4,637 Å und c = 15,02 Å.[8]
Verwendung
Magnesiumcarbonat kommt als kristallwasserhaltiges 4 MgCO3 · Mg(OH)2 · 4–5 H2O als Magnesia alba, helle Magnesia, in den Handel (CAS-Nummer 12125-28-9). Eine wässrige Suspension von 50 g/l Wasser reagiert basisch und hat einen pH von etwa 10,5.
Lebensmittel
Magnesiumcarbonat ist Bestandteil von Mineral- und Heilwässern.
Adsorber
Wegen der großen spezifischen Oberfläche von 800 m²/g eignet sich Upsalit (kristallwasserfreies nano-Magnesiumcarbonat) als Adsorber für Entfeuchter und die Bindung von Öl auf Wasser.[9][10] Auch eine Verwendung als Trägermaterial für Arzneimittelsubstanzen, bei der die Kontrollierbarkeit der Porengröße ausgenutzt wird, wird erforscht.[11]
Lebensmittelzusatzstoff
In der Lebensmittelindustrie wird Magnesiumcarbonat Lebensmitteln als Säureregulator, Trägerstoff oder Trennmittel zugesetzt. Es gilt als gesundheitlich unbedenklich, große Mengen können jedoch abführend wirken.
In der EU ist es als Zusatzstoff mit der Nummer E 504 ohne Höchstmengenbeschränkung für alle Lebensmittel zugelassen, die Zusatzstoffe enthalten dürfen. Dies beinhaltet auch Bio-Produkte.
Isolier- und Füllstoff
Es wird in Wärmeisoliermaterialien verwendet und als Füllstoff in Kunststoffen, Papier, Farben und Kautschuk sowie in der Kosmetik in Pudern.
Arzneimittel
Zusammen mit Calciumcarbonat wird Magnesiumcarbonat in Medikamenten zur Magensäureregulation (Antazida) eingesetzt.
Sport
Magnesiumcarbonat wird von den Produzenten unter den Namen Magnesiumcarbonat, Magnesia oder Chalk vertrieben. Das Produkt verwenden Gerätturner, Kraftsportler und Kletterer, um den auftretenden Handschweiß zu trocknen und damit die Griffigkeit der Hände bzw. die Gleitfähigkeit an den Geräteholmen zu erhöhen. Es ist in gepresster Blockform, als lockeres Pulver und neuerdings auch flüssig in Alkohol suspendiert erhältlich.
Sportklettern

Im Sportklettern wurde es erstmals von John Gill für das Bouldern verwendet, der die Idee aus dem Geräteturnen mitbrachte.
Die Magnesia wird dabei in verschließbaren, tragbaren Beuteln, so genannten Chalkbags, mitgeführt. Sie sind am Klettergurt hinten, auf Steißbeinhöhe, angehängt. Sobald der Kletterer während des Kletterns feuchte Hände bekommt, kann er in den geöffneten Beutel greifen. In der Regel wird Magnesia auch präventiv verwendet, damit die Hände gar nicht erst feucht werden können. Der Chalkbag wird in der Regel direkt mit Pulver oder zu Pulver zerriebenen Blöcken gefüllt. Als Alternative kann man im Beutel auch einen Chalkball mitführen. Das sind mit Magnesia gefüllte, dünne und durchlässige Stoffkugeln, welche den Vorteil eines geringeren Verbrauchs und einer verminderten Staubproduktion aufweisen. Da Staub in Kletterhallen ein Problem darstellen kann, gibt es einige Hallenordnungen, die nur Chalkballs erlauben und offene Magnesia verbieten.
In einigen Klettergebieten, wie zum Beispiel in der Sächsischen Schweiz[12], ist die Verwendung von Magnesia aus verschiedenen Gründen nicht gestattet oder zumindest unerwünscht:
- Die in den Griffen verbleibenden Reste von Magnesiumcarbonat „ziehen“ Wasser aus der Umgebung (Hygroskopie), was Griffe dauerfeucht / -rutschig macht und somit Klettern ohne Magnesia erschwert.
- Das „gezogene“ Wasser sammelt sich in bestimmten Gesteinsarten (z. B. Sandstein), bei Frost gewinnt es an Volumen und kann so die Steinoberfläche zerstören.
- Sie führt zur optischen Beeinträchtigung der Felsoberfläche (weiße Flecken an den Felsen). Für diese Verwendung gibt es auch eingefärbte Magnesia.
- Sie bewirkt eine langfristige Veränderung der physikalischen und chemischen Eigenschaften des Felses (Reduzierung der Reibung, chemische Umwandlung der Mineralien). Kritiker werfen ein, dass dies nur den Sandstein betreffe und auch dort hauptsächlich auf Vermutungen gestützt sei.[13]
- Landschaftsschutz: Das an begehrten Routen umfangreiche Einbringen eines basischen Magnesiumdüngers bewirkt an nicht dazu passenden Standorten eine Veränderung der Vegetation.
- Reduzierung der sportlichen Anforderungen: Durch die wissentliche oder auch nur als Nebeneffekt der Magnesiaverwendung erzielte Markierung der Griffe am Fels wird deren Auffinden erleichtert, womit die sportliche Herausforderung gesenkt wird.
Geräteturnen und Kraftsport
Im Turnen und auch im Kraftsport wird die Magnesia in Behältern nahe dem Leistungsort aufgestellt. Die Athleten trocknen sich dann darin vor dem Übungsbeginn die Handinnenflächen, damit ihre Haut beim Umfassen der Holme von Barren oder der Eisenstangen von Reck oder Langhantel nicht zu stark haftet.
Feuerfest-Produkte
Vor allem in der Stahl- und Eisenindustrie (Stahlgießpfannen oder Elektroöfen), aber auch in der Zement- oder Glasindustrie (Auskleidung von Drehrohröfen oder Glasschmelzöfen) werden Feuerfestmaterialien aus Magnesit gefertigt. Das Magnesit wandelt sich bei Erhitzung unter Abgabe von Kohlendioxid in Magnesiumoxid um. Der weltweit größte und bedeutendste Hersteller ist die RHI AG, die aus dem Veitsch-Radex-Konzern hervorging. Die Magnesitlagerstätten sind weltweit verteilt. In Österreich wird derzeit in der Breitenau, und in Hochfilzen Magnesit abgebaut und direkt verarbeitet.
Magnesit ist ein Zuschlagstoff oder alleiniger Ausgangsstoff für technische Keramik, für feuerfeste Tiegel und Stäbchen. Hier wandelt sich das Magnesit beim Brennen in Magnesiumoxid-Keramik um oder es wird vorher gebrannt und als Magnesiumoxid in Pulverform eingesetzt.
Einzelnachweise
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ 2,0 2,1 2,2 2,3 2,4 Eintrag zu Magnesiumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. August 2008 (JavaScript erforderlich)
- ↑ SUVA: Grenzwerte am Arbeitsplatz 2015 – MAK-Werte, BAT-Werte, Grenzwerte für physikalische Einwirkungen, abgerufen am 2. November 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 311022567-0, S. 607 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Johan Forsgren, Sara Frykstrand, Kathryn Grandfield, Albert Mihranyan, Maria Strømme: "A Template-Free, Ultra-Adsorbing, High Surface Area Carbonate Nanostructure"; In: PLOS one, doi:10.1371/journal.pone.0068486
- ↑ J. C. Deelman (2011): Low-temperature formation of dolomite and magnesite, Chapter 6 – Magnesite & huntite (PDF; 229 kB).
- ↑ K.D. Oh, H. Morikawa, S.I.Iwai, H. Aoki: The crystal structure of magnesite. In: American Mineralogist, 58, 1973, S. 1029–1033.
- ↑ Forsgren, J.; Frykstrand, S.; Grandfield, K.; Mihranyan, A. & Strømme, M.: A Template-Free, Ultra-Adsorbing, High Surface Area Carbonate Nanostructure. PLoS ONE, Public Library of Science, 2013, 8, S. e68486. doi:10.1371/journal.pone.0068486
- ↑ Spiegel Online: Unmögliches Material aus Uppsala: Upsalit aus Versehen hergestellt, 14. August 2013.
- ↑ Uppsalamaterial vielversprechend für Arzneimittel, NyTeknik, 10. August 2016, abgerufen am 7. Oktober 2016 (schwedisch).
- ↑ Bergsteigerbund
- ↑ Juliane Friedrich: Bergsport und Naturschutz in der sächsischen Schweiz -Wirkungen, Konflikte, Lösungsmöglichkeiten. 2, Diplomarbeit Technische Universität Dresden, Dresden 2002, S. 47f (www.ssi-heft.de).
| Dieser Artikel basiert ursprünglich auf dem Artikel Magnesiumcarbonat aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |

