| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Calcit
| Calcit | |
|---|---|
| Calcitzwilling | |
| Andere Namen |
|
| Chemische Formel |
Ca[CO3] |
| Mineralklasse | wasserfreie Carbonate ohne fremde Anionen 5.AB.05 (8. Auflage: V/B.02) nach Strunz 14.01.01.01 nach Dana |
| Kristallsystem | trigonal |
| Kristallklasse; Symbol nach Hermann-Mauguin | ditrigonal-skalenoedrisch 3 2/m |
| Farbe | meist farblos, milchig weiß, grau, gelb, rosa, rot, blau, grün, braun bis schwarz |
| Strichfarbe | weiß |
| Mohshärte | 3 |
| Dichte (g/cm3) | 2,6 bis 2,8; rein 2,715 |
| Glanz | Glasglanz, auch Perlmuttglanz |
| Transparenz | durchsichtig bis undurchsichtig |
| Spaltbarkeit | sehr vollkommen nach (1011)
Spaltwinkel 75° |
| Bruch | muschelig, spröde |
| Habitus | sehr unterschiedlich, Konkretionen, oolithisch, stalaktitisch, körnig, massig |
| Häufige Kristallflächen | {1010}, {0001}, {0112}, {0221} |
| Zwillingsbildung | (0001), sehr häufig Gleitzwillinge (polynynthetische Translationslamellen) nach (0112) |
| Kristalloptik | |
| Brechungsindex | bei ~590 nm: nω=1,640 bis 1,660 rein 1,658
nε=1,486 |
| Doppelbrechung (optischer Charakter) |
Δ=0,154 bis 0,174
rein 0,172; einachsig negativ |
| Optischer Achsenwinkel | 2V = kann anomal zweiachsig auftreten
2Vx dann 4-14° (bis 25°) |
| Pleochroismus | nicht vorhanden |
| Weitere Eigenschaften | |
| Chemisches Verhalten | in kalten, verdünnten Säuren unter heftigem Brausen löslich |
| Ähnliche Minerale | Aragonit, Dolomit |
| Besondere Kennzeichen | sehr starke Doppelbrechung; gelegentlich Fluoreszenz in rot oder orange; häufige Zwillingslamellen |
Calcit, Kalzit, Kalkspat oder Doppelspat, ist ein sehr häufig vorkommendes Mineral und Namensgeber der Calcitgruppe innerhalb der Mineralklasse der „Carbonate (und Verwandte)“. Es kristallisiert im trigonalen Kristallsystem mit der chemischen Zusammensetzung Ca[CO3] und entwickelt verschiedene Kristall- beziehungsweise Aggregatformen (Habitus), die entweder farblos oder von milchigweißer bis grauer, durch Verunreinigungen auch gelber, rosa, roter, blauer, grüner, brauner oder schwarzer Farbe sein können.
Mit einer Mohshärte von 3 gehört Calcit zu den weichen Mineralen und dient als Bezugsgröße auf der bis 10 (Diamant) reichenden Skala nach Friedrich Mohs.
Besondere Eigenschaften
Charakteristisch für Calcitkristalle ist eine besonders hohe Doppelbrechung. Licht, das nicht entlang der optischen Achse des Kristalls einfällt, wird in zwei Lichtbündel aufgespalten, einen ordentlichen und einen außerordentlichen Strahl. Für diese beiden Strahlen gelten auf Grund unterschiedlicher Polarisationsrichtungen andere Brechungsindizes. Dies zeigt sich darin, dass bei einem bestimmten Blickwinkel jedes durch einen klaren Kristall beobachtete Objekt doppelt erscheint, eine zur Identifikation von Calcit sehr hilfreiche Eigenschaft, daher auch der häufige Name Doppelspat. In Island, dem bekanntesten Vorkommen für Doppelspat, wird er als silfurberg (Silberfels) bezeichnet.
Verglichen mit anderen Mineralen ist Calcit kaum resistent gegenüber der Verwitterung. Er ist viel weicher als Quarz oder Feldspat und bereits in saurem Wasser löslich. In kalten, verdünnten Säuren löst sich Calcit unter heftiger Gasentwicklung auf.
Je nach Fundort kann Calcit durch Einlagerung von Seltenen Erden[2] unter UV-Licht rot, blau oder gelb, aber auch andersfarbig fluoreszieren. Weiterhin kommen auch phosphoreszierende, kathodo-, thermo- und selten auch tribolumineszierende Calcite vor.[3]
Etymologie und Geschichte
Der Name Calcit leitet sich aus dem griechischen χάλιξ chálix (m und f; Mörtel, Kalk, Kies) beziehungsweise lateinischen calx (Kalk) ab.
Klassifikation
In der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehört der Calcit zur Mineralklasse der „Carbonate, Nitrate und Borate“ und dort zur Abteilung der „Wasserfreien Carbonate ohne fremde Anionen“, wo er als namensgebendes Mineral die „Calcitgruppe“ mit der Systemnummer V/B.02 und den weiteren Mitgliedern Gaspéit, Magnesit, Otavit, Rhodochrosit, Siderit, Smithsonit, Sphärocobaltit und Vaterit bildet.
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunz'schen Mineralsystematik ordnet den Calcit in die Klasse der „Carbonate und Nitrate“ (die Borate bilden jetzt eine eigene Klasse) und dort in die Abteilung der „Carbonate ohne weitere Anionen, ohne H2O“ ein. Diese Abteilung ist nach der Elementgruppenzugehörigkeit der beteiligten Kationen weiter unterteilt, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „Erdalkali- (und andere M2+) Carbonate“ zu finden ist, wo es die nach wie vor existierende „Calcitgruppe“ mit der System-Nr. 5.AB.05 bildet. Der Vaterit bildet jetzt eine eigene Gruppe.
Die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Calcit wie die veraltete Strunz-Systematik in die gemeinsame Klasse der „Carbonate, Nitrate und Borate“ und dort in die Abteilung der „Wasserfreien Carbonate“ ein. Hier ist er ebenfalls Namensgeber der „Calcitgruppe (Trigonal: R-3c)“ mit der Systemnummer 14.01.01 und den weiteren Mitgliedern Gaspéit, Magnesit, Otavit, Rhodochrosit, Siderit, Smithsonit und Sphaerocobaltit innerhalb der Unterabteilung 14.01 Wasserfreie Carbonate mit einfacher Formel A+CO3.
Modifikationen und Varietäten

Chemisch ist Calcit (wie der ähnliche Aragonit und der Vaterit) ein Calciumcarbonat, ein Calcium-Salz der Kohlensäure.
Als Blätterspat oder auch Papierspat werden Calcitvarietäten mit dünnen, blätterartigen Kristallen bezeichnet.
Kanonenspat ist eine Calcitvarietät mit langsäulig gestrecktem, pseudohexagonalem Habitus.[4] Als Manganocalcit wird eine manganhaltige Varietät des Calcit bezeichnet.[5]
Eine Pseudomorphose von Calcit nach Ikait wird als Glendonit bezeichnet.
Bildung und Fundorte


Gebildet wird Calcit nach dem chemischen Gleichgewicht:
Das Gleichgewicht der obigen Reaktion verlagert sich mit steigender Temperatur zunehmend auf die rechte Seite. In warmen Gewässern können Lebewesen also mit geringerem Energieaufwand Kalkgehäuse bilden. In Dampfkesseln und anderen Gefäßen, in welchen kalkhaltiges Wasser erhitzt wird, entsteht auf diese Weise Kesselstein.
Calcit kann sowohl massiv als auch körnig, faserig oder in Kristallen auftreten und zeigt in letzterem Falle den höchsten Formenreichtum aller Minerale. Es ist als Gesteinsbildendes Mineral eines der häufigsten Minerale der Erdkruste und kommt sowohl in magmatischen, zum Beispiel in Karbonatiten, in metamorphen (Marmor) oder Sedimentgesteinen wie Kalkstein vor. Es tritt allein oder vergesellschaftet mit anderen Mineralen in Gängen auf, entsteht aber auch an der Erdoberfläche. Häufig entstand/entsteht Calcit durch Biomineralisation, sei es in Gesteinsformationen, im Boden, als in Teilen unerwünschter Zahnbelag (neben bevorzugt Calcium-Hydroxylapatit) usw.; hier aber immer in ganz bestimmten Mikro-Umweltbedingungen.[6]
Calcit löst sich gut in saurem Wasser und wird dadurch leicht aus Kalkstein ausgelaugt, wodurch Höhlensysteme entstehen. Der gelöste Calcit lagert sich an anderer Stelle wieder ab. Dabei entstehen die typischen Tropfsteine, die Stalagmiten und Stalaktiten.
Die weitaus größten Calcitvorkommen gehen auf Meeresablagerungen zurück. Dabei setzen sich die calcithaltigen Skelette und Schalen unzähliger kleiner Meerestiere wie etwa Muscheln, Korallen und diverser Protisten, wie die Coccolithophoriden, am Meeresgrund ab. Diese Kalkalgen sind kleiner als 30 Mikrometer und werden zum Nanoplankton gezählt. Sie bilden winzige Kalkschilde, die sogenannten Coccolithen, die nach dem Absterben der Algen auf den Ozeanboden sinken. Die Kreidefelsen von Dover bestehen aus solchen Coccolithen. Auch Korallenriffe spielen bei der Calcitbildung eine herausragende Rolle.
Anorganische, abiogene Bildungsbereiche von Calcit sind flache, im Intertidalbereich gelegene, tropische Meeresplattformen. Dort wird Calcit in Form von millimeterkleinen Kügelchen (Kalkooiden) ausgefällt. Calcit im Marmor geht auf thermische Metamorphose von Calcitsedimenten zurück.
Ab einer Meerestiefe von 3500 Metern, der so genannten Calcit-Kompensationstiefe, löst sich Calcit vollständig in Wasser. Daher bleiben in dieser Tiefe weder calcithaltige Sedimente noch Muschelschalen oder Skelette erhalten.
Calcit kommt als Einlagerung in die Statolithenmembran der Makulaorgane des Innenohres vor. Es spielt dort eine große Rolle bei der Wahrnehmung von Beschleunigungen und der Lotrichtung.
Bekannt aufgrund außergewöhnlicher Calcitfunde ist vor allem Island, wo neben dem wasserklaren Doppelspat auch die bisher größten Kristalle gefunden wurden. Am Helgustadir nahe Reyðarfjörður hatte der größte Kristall eine Abmessungen von 7 m × 7 m × 2 m und der schwerste ein Gewicht von 280 t.[7] In der „Sterling Bush“-Höhle im Lewis County (New York) wurde ein Calcit-Rhomboeder von 109 cm × 95 cm × 46 cm und einem Gewicht von rund 500 kg gefunden.[8]
Einer der größten in Museen ausgestellten Calcite befindet sich im Natural History Museum. Er hat ein Gewicht von 230 kg.[9]
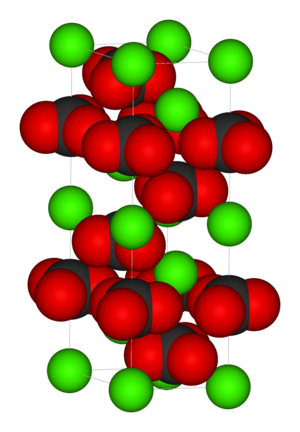
Kristallstruktur
Calcit kristallisiert trigonal in der Raumgruppe R 3 c (Raumgruppen-Nr. 167) mit den Gitterparametern a = 4,99 Å und c = 17,06 Å sowie 6 Formeleinheiten pro Elementarzelle.[10]
Verwendung
Baumaterial und Rohstoff
Die calcithaltigen Gesteine Marmor, Kalkstein und Onyxmarmor sind ein hochwertiges Dekorations- und Baumaterial, daneben wird Calcit in Kalkstein zur Produktion von Zement und Kunstdünger und als Zuschlagstoff bei der Verhüttung von Erzen eingesetzt. Besonders reine Kristalle werden wegen ihrer optischen Eigenschaften in der optischen Industrie, insbesondere in der Polarisationsoptik, beispielsweise in Form von Glan-Taylor-Prismen oder als Verzögerungsplatte verwendet. Außerdem wird es in sauren, rutilumhüllten und basischen Elektroden als Schutzgasbildner beim Lichtbogenhandschweißen eingesetzt.
Schmuckstein
Calcit ist für eine kommerzielle Schmucksteinherstellung eigentlich zu weich. Gelegentlich wird er aber dennoch im Glattschliff als Cabochon oder Trommelstein angeboten. Versierten Sammlern gelingt es darüber hinaus auch, Calcit in Facettenform zu bringen.[11]
Terrariensand
Aufgrund der Säurelöslichkeit wird Calcit in Form von „Caltrat“ in Terrarien eingesetzt. Terrarientiere, die auf herkömmlichen (unverdaulichen) Fluss- und/oder Quarzsanden gehalten worden waren, litten nach der Aufnahme dieser Sande an oft tödlich verlaufenden Verstopfungen. Durch die Verwendung von (verdaulichem) Caltrat wird diese Gefahr weitgehend ausgeschlossen.
Doppelspat wurde möglicherweise von den Wikingern bei ihren Fahrten als Navigationshilfe benutzt. Aufgrund seiner doppelbrechenden Eigenschaften entstehen bei der Betrachtung der Sonne durch einen solchen Kristall zwei Lichtbündel, deren Intensität vom Einfallswinkel des Sonnenlichts abhängig ist. Sind beide Lichtbündel in ihrer Intensität identisch, so ist der Kristall zur Sonne ausgerichtet. Forscher stellten in einem Experiment fest, dass dies selbst bei Bewölkung und sogar bis zu 40 Minuten nach Sonnenuntergang zuverlässig funktioniert.[12][13][14]
Siehe auch
Einzelnachweise
- ↑ Thompson, D.W. et al 1998. Determination of optical anisotropy in calcite from ultraviolet to mid-infrared by generalized ellipsometry. Thin Solid Films 313–314 (1998) S. 341–346; doi:10.1016/S0040-6090(97)00843-2.
- ↑ Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4. durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1979, ISBN 3-342-00288-3, S. 695.
- ↑ John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols: Calcite, in: Handbook of Mineralogy, Mineralogical Society of America, 2001 (PDF 66,2 kB englisch)
- ↑ Mineralienatlas:Kanonenspat
- ↑ Mineralienatlas:Manganocalcit
- ↑ (Schmittner und Giresse, 1999)
- ↑ Mineralienatlas:Mineralrekorde
- ↑ American Mineralogist – The largest crystal
- ↑ Isländischer Spat Calcit
- ↑ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 286.
- ↑ Walter Schumann: Edelsteine und Schmucksteine. 13. Auflage. BLV Verlags GmbH, 1976/1989, ISBN 3-405-16332-3 (S. 224)
- ↑ SCINEXX: Wikinger nutzten transparentes Mineral als Sonnenkompass
- ↑ Guy Ropars, Gabriel Gorre1, Albert Le Floch, Jay Enoch, Vasudevan Lakshminarayanan: A depolarizer as a possible precise sunstone for Viking navigation by polarized skylight. In: Proceedings of the Royal Society A. 2011, doi:10.1098/rspa.2011.0369.
- ↑ Albert Le Floch, Guy Ropars, Jacques Lucas, Steve Wright, Trevor Davenport, Michael Corfield, Michael Harrisson: The sixteenth century Alderney crystal: a calcite as an efficient reference optical compass?. In: Proceedings of the Royal Society A. 469, Nr. 2153, 2013, doi:10.1098/rspa.2012.0651.
Literatur
- Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer, Berlin/Heidelberg/New York 2005. ISBN 3-540-23812-3
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel, Eggolsheim 2002, ISBN 3-89555-076-0
- W. E. Tröger, H.U. Bambauer, F. Taborszky und H. D. Trochim: Optische Bestimmung gesteinsbildender Minerale, Teil 1: Bestimmungstabellen. Schweizerbart, Stuttgart 1981
- Karl-Erich Schmittner, Pierre Giresse: Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils. Roussillon, France 1999. In: Sedimentology 46/3: 463-476.
Weblinks
- Mineralienatlas:Calcit (Wiki)
- Isländischer Spat
- Chinesische Riesencalcite
- Webmineral (engl.)
- MinDat – Calcite (engl.)
| Dieser Artikel basiert ursprünglich auf dem Artikel Calcit aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |