| Jewiki unterstützen. Jewiki, die größte Online-Enzyklopädie zum Judentum.
Helfen Sie Jewiki mit einer kleinen oder auch größeren Spende. Einmalig oder regelmäßig, damit die Zukunft von Jewiki gesichert bleibt ... Vielen Dank für Ihr Engagement! (→ Spendenkonten) |
How to read Jewiki in your desired language · Comment lire Jewiki dans votre langue préférée · Cómo leer Jewiki en su idioma preferido · בשפה הרצויה Jewiki כיצד לקרוא · Как читать Jewiki на предпочитаемом вами языке · كيف تقرأ Jewiki باللغة التي تريدها · Como ler o Jewiki na sua língua preferida |
Graphit
| Graphit | |
|---|---|
| Sehr reiner Graphit aus dem ehemaligen Ceylon, heute Sri Lanka | |
| Andere Namen | |
| Chemische Formel | |
| Mineralklasse | Elemente – Halbmetalle, Nichtmetalle 1.CB.05a (8. Auflage: I/B.02) nach Strunz 01.03.06.02 nach Dana |
| Kristallsystem | hexagonal |
| Kristallklasse; Symbol nach Hermann-Mauguin | dihexagonal-dipyramidal; 6/m 2/m 2/m |
| Farbe | grau bis schwarz |
| Strichfarbe | grauschwarz |
| Mohshärte | 1 bis 2 |
| Dichte (g/cm3) | 2,1 bis 2,3, beim idealen Einkristall 2,26[3] |
| Glanz | Metallglanz, matt |
| Transparenz | undurchsichtig |
| Spaltbarkeit | vollkommen, Schichtabstand 0,335 nm beim idealen Einkristall[3] |
| Bruch | uneben, biegsam |
| Habitus | {{{Kristallhabitus}}} |
| Häufige Kristallflächen | {001} |
| Kristalloptik | |
| Doppelbrechung (optischer Charakter) |
; einachsig negativ |
| Pleochroismus | stark rot |
| Weitere Eigenschaften | |
| Chemisches Verhalten | unlöslich in nicht-oxidierenden Säuren |
| Magnetismus | diamagnetisch |
| Besondere Kennzeichen | hohe Anisotropie (z. B. Härte, Leitfähigkeit) |
Graphit, nach neuer deutscher Rechtschreibung auch Grafit, ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der „Elemente“. Er ist eine der natürlichen Erscheinungsformen des chemischen Elements Kohlenstoff in Reinform. Er kristallisiert meist im hexagonalen, sehr selten auch im trigonalen Kristallsystem.
Graphit bildet undurchsichtige, graue bis schwarze Kristalle in sechseckiger, tafeliger, schuppiger oder stängeliger Form, die auf den Kristallflächen Metallglanz aufweisen. Massige oder körnige Aggregate sind dagegen matt. Seine Mohshärte beträgt zwischen 1 und 2, seine Dichte etwa 2,1 bis 2,3 g/cm³, und er hat eine grauschwarze Strichfarbe.
Etymologie und Geschichte
Der Name Graphit leitet sich aus dem Altgriechischen γράφειν [graphein] ab, was schreiben bedeutet.[4] Er spielt damit auf die Tatsache an, dass Graphit auf Papier oder anderen rauen Oberflächen durch Abreibung der einzelnen Blättchen leicht eine graue Ablagerung hinterlässt, die im Bleistift (veraltet auch Reißblei oder Wasserblei) ihre Anwendung findet. Abraham Gottlob Werner[5] prägte 1789 den Namen, der sich dann international in der mineralogischen Fachwelt durchsetzte und auch von der International Mineralogical Association (IMA) übernommen wurde.[6]
Nach neuer deutscher Rechtschreibung ist die Schreibweise Grafit laut Duden die empfohlene Schreibweise,[7] bei canoonet dagegen als Nebenvariante erlaubt[1]. Gemäß der Empfehlung vom Rat für deutsche Rechtschreibung sind die Schreibweisen Graphit und Grafit allerdings gleichwertig.[2] Fachlich korrekt ist jedoch nach wie vor die Schreibweise Graphit.[6]
Die Verwendung von Graphit kann in der prähistorischen Zeit auf eine lange Tradition in Europa zurückblicken. Die ersten Hinweise einer Verwendung kennt man aus dem Mesolithikum Norditaliens. Rohgraphitstücke wurden als Färbemittel benutzt und den Toten in die Gräber mitgegeben. Für das Neolithikum finden sich in Böhmen zahlreiche Belege von Graphitton– und graphitierter Keramik. In Bayern fällt in der Frühbronzezeit vor allem die Straubinger Kultur durch starken Graphitgebrauch auf.
In der späten Eisenzeit in Mitteleuropa (Latènezeit) wurde Graphit gerne verwendet, um Gefäße, vor allem Kochtöpfe, feuerfester zu machen. Es fand während dieser Zeit ein großflächiger Handel statt, der die gesamte Verbreitung der Latène-Kultur umfasste. Hier waren besonders die Vorkommen bei Passau und Krummau bedeutsam. Nach dem Zusammenbruch der keltischen Kultur in Mitteleuropa im Zuge der römischen Eroberung und der germanischen Expansion dauert es etwa 800 Jahre bis ins frühe Mittelalter, bis im slawischen Ostmitteleuropa im größeren Stil wieder Graphit verwendet wurde. In Asien (vor allem dem schon frühzeitig schriftkundigen China) hat Graphit als Schreibmaterial erstaunlicherweise keine Rolle gespielt.
Im 16. Jahrhundert entdeckten die Engländer ein großes Vorkommen an reinem Graphit, welches sie jedoch für eine Form des Bleiminerals Bleiglanz (Plumbago) hielten. Erst Carl Wilhelm Scheele gelang 1779 der Nachweis, dass es sich bei Graphit um reinen Kohlenstoff handelt. Trotz Scheeles Nachweis hält sich der Begriff Bleistift bis heute. Da sich Graphit nicht nur als gutes Schreibmaterial, sondern auch als perfektes Material für Gussformen von Kanonenkugeln herausstellte, hatte er auch eine gewisse militärische Bedeutung. So wurde deshalb z. B. während der napoleonischen Kriege Anfang des 19. Jahrhunderts die Ausfuhr von Bleistiften von Großbritannien nach Frankreich verboten.[8]
Klassifikation
Bereits in der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Graphit zur Mineralklasse der „Elemente“ und dort zur Abteilung der „Halbmetalle und Nichtmetalle“, wo er zusammen mit Chaoit, Diamant, Fullerit, Lonsdaleit und Moissanit „Kohlenstoff-Gruppe“ mit der System-Nr. I/B.02 bildete.
Die seit 2001 gültige und von der IMA verwendete 9. Auflage der Strunz’schen Mineralsystematik ordnet den Graphit ebenfalls in die Klasse der „Elemente“ und dort in die Abteilung der „Halbmetalle (Metalloide) und Nichtmetalle“ ein. Diese Abteilung ist allerdings weiter unterteilt nach den in der Verbindung auftretenden Hauptelementen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „Kohlenstoff-Silicium-Familie“ zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe 1.CB.05a bildet.
Auch die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Graphit in die Klasse der „Elemente“ und dort in die gleichnamige Abteilung ein. Hier ist er zusammen mit Diamant, Lonsdaleit, Chaoit und Fullerit in der „Gruppe der Kohlenstoffpolymorphe“ mit der System-Nr. 01.03.06 innerhalb der Unterabteilung „Elemente: Halbmetalle und Nichtmetalle“ zu finden.
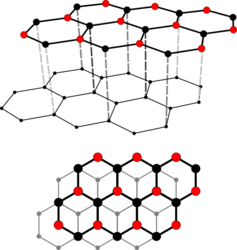
Kristallstruktur
Im kristallinen Graphit liegen parallel verlaufende ebene Schichten, die „Basalebenen“ oder „Graphen-Schichten“, vor. Eine Schicht besteht aus kovalent verknüpften Sechsecken, deren Kohlenstoff-Atome sp2-hybridisiert sind. Innerhalb dieser Ebenen beträgt die Bindungsenergie zwischen den Kohlenstoff-Atomen 4,3 Elektronenvolt, zwischen ihnen dagegen lediglich 0,07 Elektronenvolt. Aus dieser extremen Richtungsabhängigkeit der Bindungskräfte resultiert eine deutliche Anisotropie der mechanischen, elektrischen und thermischen Eigenschaften des Graphits:
- leichte Spaltbarkeit des reinen Graphits entlang der Basalebenen, deutlich höhere Festigkeit entlang der Kristallschichten;
- thermische und elektrische Isolation orthogonal zu den Basalebenen gegenüber einer fast metallischen Leitfähigkeit entlang der Ebenen.
Die Leitfähigkeit innerhalb einer Ebene wird durch die Delokalisation der π-Elektronen ermöglicht.
Die bekannten Schmiermitteleigenschaften von Graphit sind jedoch nicht nur strukturbedingt, denn sie treten nur in Gegenwart von Feuchtigkeitsspuren auf.[9]
Weisen die Ebenen keine feste Korrelation zueinander auf, spricht man von turbostratischem Kohlenstoff.
Die durchstrahlungs-elektronenmikroskopische (TEM-)Aufnahme zeigt Basalebenenstapel in Graphit. Die Überlagerung verkippter Stapel erzeugt Moiré-Streifen; die Basalebenenabstände von 0,335 Nanometer werden hier nicht aufgelöst.[3]
Im sogenannten Glaskohlenstoff liegen die Ebenen dagegen nicht planparallel wie die Seiten eines Buches, sondern wie geknülltes Papier. Dieser Kohlenstoff ist hart und isotrop wie Glas, daher sein Name. Durch besondere Behandlung (Streckung von Kunststofffasern und anschließendes Graphitieren) gelingt es, die Ebenen in Faserrichtung zu orientieren. Das Ergebnis sind hochfeste Kohlenstofffasern.
Fullerene und Nanoröhren besitzen nur eine Basalebene, die im ersten Fall zu einer Kugel, im zweiten Fall zu Röhren gekrümmt sind. Auch hier sind die Übergänge zum Graphit fließend. Weitere Schichten können sich zwiebelartig anlagern und rußartiges Pulver bilden.
Rastertunnelmikroskopische Aufnahme einer Graphitoberfläche. Hell zu sehen sind diejenigen Oberflächenatome (rot markiert im nebenstehenden Bild), die kein unmittelbares Nachbaratom in der nächstunteren Schicht besitzen (mit gestrichelten Linien verbundene Atompositionen), da hier die elektronische Zustandsdichte höher ist. Ein unteres C-Atom ändert die elektronische Struktur des darüberliegenden Atoms.
Eigenschaften
Graphit sublimiert in einer sauerstofffreien Umgebung bei einer Temperatur von 3825 °C. Unter Sauerstoffeinwirkung entzündet sich Graphit bei etwa 600 °C[10]. Graphit ist beständig gegen nichtoxidierende Säuren und ist diamagnetisch. Auffällig ist das stark anisotrope Verhalten von Graphit, insbesondere hinsichtlich Härte und elektrischer Leitfähigkeit.
Modifikationen und Varietäten
Graphit ist neben Diamant und Fulleren die dritte unter irdischen Normalbedingungen stabile Form (Modifikation) des Kohlenstoffs. Eine weitere Modifikation, der Lonsdaleit, entsteht nur durch außergewöhnliche Schockereignisse wie beispielsweise bei einem Meteoriteneinschlag.
Bildung und Fundorte
Graphit kommt in der Natur in Form vereinzelter Flocken und Körner in kohlenstoffreichem metamorphem Gestein und als Adern in Pegmatit vor.
Es existieren zahlreiche Graphitfundorte weltweit.[11] Von wirtschaftlicher Bedeutung sind aber vor allem die Volksrepublik China, Korea, Madagaskar, Simbabwe, Brasilien und Indien sowohl im Tagebau als auch unter Tage. Pro Jahr handelt es sich dabei um ca. 600.000 Tonnen.
In Europa gibt es zurzeit nur noch wenige aktive Graphitbergwerke. In der Ukraine, in Norwegen und in Tschechien wird makrokristalliner Naturgraphit in unterschiedlicher Qualität unter Tage abgebaut. Bei dem makrokristallinen Naturgraphit sind die einzelnen Graphitkristallitpakete (Flocken) gut erhalten und sichtbar. In Österreich wurden dagegen mikrokristalline Naturgraphite gewonnen, deren Kristalle nicht so deutlich ausgeprägt sind.
Österreich nahm in den 1960er-Jahren den nach Südkorea zweiten Platz unter den graphitfördernden Ländern ein (Höchststand 1964 mit etwa 100.000 Tonnen Förderung). Der größte Bergbau befand sich in Kaisersberg bei Sankt Stefan ob Leoben in der Steiermark. Er wurde 1997 stillgelegt; seit Frühjahr 2008 wird im dortigen "Marie-Stollen" wieder gearbeitet. Bis 1991 bestand in Sunk bei Trieben im Paltental (Steiermark) ein Bergbau, in dem Graphit mit einem sehr hohen Kohlenstoffanteil von zum Teil über 85 % gewonnen wurde. Weitere kleine Graphitbergbaue bestanden bis in die 1970er-Jahre am Semmering, im Liesingtal (Steiermark), im Dunkelsteiner Wald (Niederösterreich) sowie im Waldviertel, wo das seit 1831 in Abbau stehende Vorkommen in Mühldorf[12] am bedeutendsten war.
In Deutschland war und ist der Graphit-Bergbau von Kropfmühl/Landkreis Passau bedeutsam. Am 21. Juni 2012 wurde das Graphitbergwerk am Standort Kropfmühl offiziell wieder eröffnet. Der Abbau ist, laut einer Pressemitteilung des Unternehmens, aufgrund der steigenden Nachfrage nach Graphit und der Preisentwicklung am Weltmarkt wieder rentabel geworden.[13]
Synthetische Herstellung
Durch Verkoken kohlenstoffhaltiger Materialien entstehen graphitierbare Kohlenstoffe. Ausgangssubstanzen sind zum Beispiel Braunkohle, Steinkohle, Erdöl und Peche, aber auch Kunststoffe. Bei der Graphitierung erfolgt durch Erhitzen unter Luftabschluss auf etwa 3.000 °C eine Umwandlung vom amorphen Kohlenstoff zum polykristallinen Graphit.
Künstlich hergestellter Graphit ist auch als Acheson-Graphit bekannt. Bedeutende Hersteller sind unter anderem SGL Carbon (Deutschland), Schunk Kohlenstofftechnik (Deutschland) und Morgan Crucible (Großbritannien).
Highly ordered pyrolytic graphite (HOPG) ist eine sehr reine Form von Graphit.
Verwendung
Graphitelektroden
2011 wurden 42 % aller synthetischen Graphite zu Elektroden verarbeitet. So werden für Herstellung einer Tonne Elektrostahl im Durchschnitt 2–2,5 kg Graphit verbraucht.[14] Größter Hersteller ist hier SGL Carbon.
- Elektrode im Lichtbogenofen (zur Elektrostahlgewinnung)
- Elektrode in Kohlebogenlampen
- Kohlebürste in elektrischen Motoren
- negative Elektrode von Lithium-Ionen-Zellen
- positive Elektrode von Zink-Kohle-Primärzellen
- Elektrode beim Senkerodieren
- Schleifleisten auf dem Stromabnehmer von Schienenfahrzeugen
Nukleargraphit
Graphit wurde und wird in hochgereinigter Form in manchen Kernreaktor-Typen als Moderator eingesetzt. In den deutschen, inzwischen stillgelegten "Kugelhaufenreaktoren" Versuchsreaktor Jülich und THTR-300 diente Graphit zugleich als Moderator und Brennelementmatrix. Die guten Moderationseigenschaften und die hohe Temperaturstabilität waren für den Einsatz in der Nukleartechnik ausschlaggebend.
Die Graphitbrände des britischen Windscale-Reaktors 1957 in Sellafield sowie des RBMK-Reaktors in Tschernobyl 1986 führten jedoch zu Bedenken wegen der Sicherheit von Graphit in Reaktoren. Als Probleme kommen hinzu die Reaktionsfähigkeit mit Wasserdampf (> 900 °C) unter Bildung brennbarer Gase und die Neigung zu energetischen Instabilitäten (siehe Wigner-Energie).
2006 gab es weltweit 250.000 t bestrahlten Nukleargraphit (Deutschland ca. 1000 t), für den es wegen seines hohen Gehalts an C-14 (radioaktives Isotop mit einer Halbwertszeit von 5700 Jahren) noch keine ökonomisch akzeptable Endlagerstrategie gibt.[15]
Weitere Verwendungsmöglichkeiten
Graphit wird vielfältig genutzt als
- Bleistiftmine
- teilweise: Golfschläger
- teilweise: Badmintonschläger
- teilweise: Tennisschläger
- Festschmierstoff
- Werkstoff für selbstschmierende Lager und Dichtungen
- Füller zur Verbesserung der elektrischen Leitfähigkeit und zum Herabsetzen des Reibbeiwertes von Kunststoffen
- Schmelztiegel
- Gießform
- thermisch hochbelastbare Ofenauskleidung
- Monochromator im Einkristalldiffraktometer
- Standardsubstrat in der Rastertunnelmikroskopie unter Umgebungsbedingungen.
- Waffe in Form von Graphitfäden zum Kurzschließen der feindlichen Stromversorgung (Graphitbombe)
- korrosionsbeständiger Werkstoff in der chemischen Industrie
- Wanne und Elektroden bei der Aluminiumherstellung (Schmelzflusselektrolyse)
- Legierungselement in Gusseisen
- Phasenwechselmaterial
Siehe auch
Literatur
- Ernst H. Weinschenk: Der Graphit, seine wichtigsten Vorkommnisse und seine technische Verwerthung. Verl.-Anst. und Dr. A.-G., Hamburg 1898 (Digitalisat der ULB Düsseldorf)
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. (Übersetzt von Werner Horwath). Edition Dörfler im Nebel Verlag, Eggolsheim 2002, ISBN 3-89555-076-0.
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. 4. Auflage. Weise, München 2002, ISBN 3-921656-17-6.
- Eugen Ryschkewitsch: Graphit. Charakteristik, Erzeugung, Verarbeitung und Verwendung. S. Hirzel, Leipzig 1926.
- Irene Kappel: Die Graphittonkeramik von Manching. F. Steiner, Wiesbaden 1969.
- Wolfgang Delle et al. Graphitische Werkstoffe für den Einsatz in Kernreaktoren. 2. polykristalliner Graphit und Brennelementmatrix Thiemig, München, 1983
Weblinks
- Mineralienatlas:Graphit (Wiki)
- Webmineral – Graphite (englisch)
- Mineral & Exploration – Aktuelle Karte von Graphitbergwerken und Produzenten 2012
- MinDat – Graphite (englisch)
- Metallorganische 2D-Netzwerke auf einer Graphitoberfläche dargestellt mit einem Rastertunnelmikroskop
Einzelnachweise
- ↑ 1,0 1,1 canoo.net: Grafit (Schreibweise nach neuer Rechtschreibung als Nebenvariante erlaubt)
- ↑ 2,0 2,1 Rat für deutsche Rechtschreibung - Wörterbuch (Stand 2006) (PDF 2,22 MB; Grafit/Graphit S. 58)
- ↑ 3,0 3,1 3,2 Harry Marsh, Francisco Rodríguez-Reinoso: Science of Carbon Materials. 2000. Zitiert in: Christian Anton Rottmair: Einfluss der thermischen Prozessführung auf die Eigenschaften von Graphitformteilen, hergestellt durch Pulverspritzguss von Mesophasen-Kohlenstoff. 2007, S. 10-11 (Dissertationsarbeit, Universität Erlangen-Nürnberg, 2007, (PDF)). urn:nbn:de:bvb:29-opus-11781
- ↑ Hans Lüschen: Die Namen der Steine. Das Mineralreich im Spiegel der Sprache. 2. Auflage. Ott Verlag, Thun 1979, ISBN 3-7225-6265-1, S. 232.
- ↑ A. G. Werner: Mineralsystem des Herrn Inspektor Werners mit dessen Erlaubnis herausgegeben von C.A.S. Hoffmann. In: Alexander Wilhelm Köhler (Hrsg.): Bergmännisches Journal. Band 1, Crazische Buchhandlung, Freyberg 1789, S. 369–386 (PDF 1,83 MB; Graphit S. 13)
- ↑ 6,0 6,1 IMA/CNMNC List of Mineral Names; Dezember 2014 (PDF 1,5 MB)
- ↑ Grafit bei duden.de
- ↑ Andre K. Geim, Philip Kim: Wunderstoff aus dem Bleistift. In: Spektrum der Wissenschaft, August 2008, S.86–93 (online verfügbar bei spektrum.de)
- ↑ Bing K. Yen, Birgit E. Schwickert: Origin of low-friction behavior in graphite investigated by surface x-ray diffraction (PDF; 215 kB), Mai 2004.
- ↑ Sicherheitsdatenblatt Graphit (PDF; 22 kB)
- ↑ mindat.org: Localities for Graphite (englisch)
- ↑ familie-wimmer.com: 1 1/2 Jahrhunderte Grafitbergbau in Mühldorf, abgerufen am 26. Mai 2013.
- ↑ Wiederaufnahme des Graphitabbaus in Kropfmühl. Pressemitteilung. Graphit Kropfmühl AG, 21. Juni 2012, abgerufen am 18. Juli 2012.
- ↑ Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg (4.); Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner (3.): Industrielle Anorganische Chemie. 4 Auflage. Wiley-VCH, 2013, ISBN 978-3-527-33019-5, S. 633 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ J. Fachinger, W. von Lensa, T. Podruhzina: Decontamination of nuclear graphite. In: Proceedings HTR2006: 3rd International Topical Meeting on High Temperature Reactor Technology, October 1–4, 2006, Johannesburg, South Africa. 2006, S. J00000063.
| Dieser Artikel basiert ursprünglich auf dem Artikel Graphit aus der freien Enzyklopädie Wikipedia und steht unter der Doppellizenz GNU-Lizenz für freie Dokumentation und Creative Commons CC-BY-SA 3.0 Unported. In der Wikipedia ist eine Liste der ursprünglichen Wikipedia-Autoren verfügbar. |